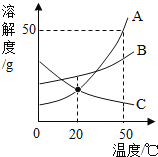
��Ŀ����
����Ŀ��С����ʵ���ҷ���һƿ�������ƹ���û������ƿ����������������ͬѧһ�����ƿ�������ƹ���չ��̽��������������һ�����̽����
��������⡿��ƿ�������ƹ����Ƿ���ʣ�
���������ϡ�CaCl2��Һ�����ԣ�
����������衿����������û�б��ʣ��ڸ��������Ʋ��ֱ��ʣ��۸��������� ��
�����ʵ�顿ȡ�������ƹ�����Ʒ����ˮ�����ҺA����������ʵ�飺
ʵ�鲽�� | ʵ������ | ���ۼ����� |
��1��ȡ������ҺA���Թ��У������еμ�������ϡ��� | �����ݲ��� | ���� ������ |
��2����ȡ������ҺA���Թ��У������еμ��������Ȼ�����Һ�� | ���� | ��Ӧ�Ļ�ѧ����ʽΪ�� |
��3�������裨2�����õĻ��Һ���ã����ϲ���Һ�еμ���ɫ�ķ�̪��Һ�� | ��Һ�ʺ�ɫ | ���� ���� |
����˼�뽻�������õ��������Ʊ��ʵ�ԭ���ǣ��û�ѧ����ʽ��ʾ�� ����ˣ���������Ӧ ���森
��̽������չ��Ϊ��һ��̽���������Ƶı��ʳ̶ȣ�С����ȡ18.6g�������ƹ�����Ʒ�����ձ��У���������μ���ϡ���ᣬ�����ٲ�������Ϊֹ��������ϡ����100g����Ӧ��Ƶ��ձ�����Һ������Ϊ114.2g���Լ��㣺
��1������Ʒ��̼���Ƶ�����Ϊ ��
��2�����������Ƶı��ʳ̶ȣ������ʵ���������ռ����ǰ���������Ƶ�����������Ϊ ��
���𰸡�����������衿��ȫ������
�����ʵ�顿
ʵ�鲽�� | ʵ������ | ���ۼ����� |
��1�� | �� | |
��2�� | ��ɫ���� | Na2CO3+CaCl2=CaCO3��+2NaCl |
��3�� | �� |
����˼�뽻����
CO2+2NaOH=Na2CO3+H2O���ܷ�
��̽������չ����1��10.6����2��50%
��������
����������衿�����ǶԿ��ܵ�������м��裮����һ����ƿ����������Һδ���ʣ����������ƿ����������Һ���ֱ��ʣ����Ի��е��������������ȫ���ʣ�
�����ʵ�顿��1��̼�����е�̼�������һ����ϡ������飬��������ݲ�������֤���Ѿ����ʣ��ʢٲ�������
��2�������һ��̽���Ƿ���ȫ���ʣ������ȼ��������ĸ����ӣ���̼���ȫ����ȥ��
��3��Ȼ�����÷�̪��Һ�����Ƿ����������ƣ�����а�ɫ�������ɣ���ɫ��̪��Һ����ɫ��֤��NaOH��ȫ�����ʣ�
����˼�뽻�������������ƹ��屩¶�ڿ�������������ˮ�ֶ����⣬���տ����еĶ�����̼�����ʣ���ѧ����ʽ��ʾΪ��CO2+2NaOH=Na2CO3+H2O����ˣ���������Ӧ�ܷⱣ�棻
��̽������չ�������������֪�ų���������Ϊ4.4g����CO2��������
�����Ʒ��̼���Ƶ�����Ϊx
Na2CO3+2HCl�T2NaCl+H2O+CO2��
106 44
x 4.4g
![]()
x=10.6g
����ʵ��������Ƶ�������y
CO2+2NaOH=Na2CO3+H2O
80 106
y 10.6g
![]()
y=8g
û�б����������Ƶ�������18.6g��10.6g=8g
�ѱ����������Ƶ���������=8/��8g+8g��*100%=50%

����Ŀ��Ϊ��ȥ�±���Ʒ�е��������ʣ�������Ϊ���ʣ�����ѡ�Լ���������������ȷ����
��� | ��Ʒ�ɷ� | ��ѡ�Լ� | �������� |
A | KCl��MnO2�� | ˮ | �ܽ⡢���ˡ�ϴ�Ӹ��� |
B | Na2CO3��NH4HCO3�� | �������������ټ��� | |
C | NaCl��KNO3�� | ˮ | �ܽ⡢���½ᾧ������ |
D | NaCl��MgCl2�� | ����NaOH��Һ | ���ˡ������ᾧ |