题目内容
【题目】水是生命之源,“珍惜水、 节约水、保护水”是每个公民的义务和责任。
(1)下列“水”属于纯净物的是____________(填字母) ;
A 蒸馏水
B 河水
C 自来水
D 矿泉水
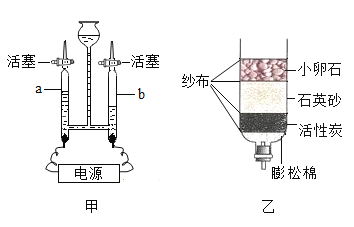
(2)用如图甲装置进行电解水的实验,a中收集到的气体是_____,可以用__________________检验,该实验说明水是由_______________组成的。
(3)生活中可用____________的方法降低水的硬度;某同学自制如图乙所示简易净水器,图中活性炭的主要作用是___________________。
(4)如图为甲和乙两种固体物质的溶解度曲线。回答下列问题
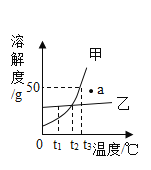
①图中a点对应的甲溶液是________(填“饱和”或“不饱和”)溶液。
②当温度为t3°C时,要将100g质量分数为20%的甲溶液变成饱和溶液,需要加入_________g甲固体(不含结晶水)。
【答案】A 氧气 带火星的木条 氢元素和氧元素 煮沸 吸附色素和异味等 不饱和 20
【解析】
电解水正极生成氧气,负极生成氢气,氧气具有助燃性,能使带火星的木条复燃,活性炭具有吸附性。
(1)A、蒸馏水属于纯净物,故A正确;
B、河水含有杂质,属于混合物,故B不正确;
C、自来水含有杂质,属于混合物,故C不正确;
D、矿泉水含有有可溶性杂质,属于混合物,故D不正确。故选A。
(2)电解水正极生成氧气,负极生成氢气,氧气和氢气的体积比为1:2,故a中收集到的气体是氧气,氧气具有助燃性,能使带火星的木条复燃,故可以用带火星的木条检验,该实验说明水是由氢元素和氧元素组成的。
(3)生活中可用煮沸的方法降低水的硬度,活性炭具有吸附性,主要作用是吸附色素和异味等。
(4)①a点在甲溶解度曲线的下面,故图中a点对应的甲溶液是不饱和溶液。
②温度为t3°C时,甲物质的溶解度为50g,100g质量分数为20%的甲溶液中溶质的质量为![]() ,设需要加入甲固体的质量为x,
,设需要加入甲固体的质量为x,![]() ,
,![]() ,故将100g质量分数为20%的甲溶液变成饱和溶液,需要加入20g甲固体(不含结晶水)。
,故将100g质量分数为20%的甲溶液变成饱和溶液,需要加入20g甲固体(不含结晶水)。

【题目】化学兴趣小组进行铁生锈的实验探究活动:
[探究一]铁生锈的条件
[实验 1]将洁净无锈的铁丝置于如图一所示装置中,关闭止水夹 K, 经过一段时间观察,装置中的铁丝没有锈迹。
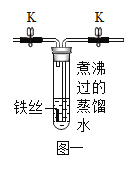
(1)蒸馏水经过煮沸的目的是_______________。
(2)铁丝没有锈迹说明了______________。
[实验 2]打开止水夹 K,通入 O2,排出试管中的水(试管底部留少量的水),如图二所示,关闭止水夹 K,经过一段时间观察到铁丝生锈严重。
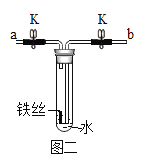
(3)通入 O2 时,应从__________端(填“a”或“b”)通入。
[实验 3]兴趣小组认为根据以上两个实验的现象还不足以得出铁生锈是与氧气和水共同作用的结论,于是利用图一装置补做了一个实验。
(4)简述兴趣小组补做实验的具体方法方法和观察到的现象______________。
[探究二] 酸性条件下铁发生腐蚀的影响因素
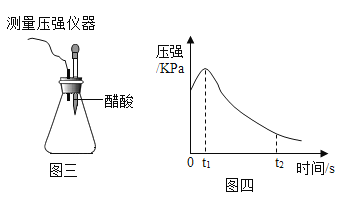
[实验 4]将混合均匀的铁粉和碳粉置于锥形瓶底部,塞上瓶塞(如图三)。从胶头滴管中滴入几滴醋酸溶液,同时测量容器中的压强变化。
编号 | 实验目的 | 碳粉/g | 铁粉/g | 醋酸/% |
① | 为以下实验做参照 | 1.0 | 3.0 | 80.0 |
② | 探究醋酸浓度的影响 | 1.0 | 32.0 | |
③ | 0.5 | 3.0 | 80.0 |
资料:碳粉不参与锥形瓶中的化学反应,醋酸溶液显酸性。
(5)上表中编号②实验中铁粉的质量为_____________;编号③试验的实验目的是___________。
(6)编号①试验测得容器中压强随时间变化如图四,t2 时容器中压强明显小于起始压强,其原因是___________。
(7)兴趣小组总结了图四中 0~t1 时压强增大的原因,可能是__________。
(拓展延伸)
(8)铁锈的主要成分是 Fe2O3,它是由铁生锈过程中产生的红褐色固体 Fe(OH)3 分解产生的,写出 Fe(OH)3 受热分解产生两种氧化物的化学方程式_____________。
(9)为了防止钢铁锈蚀,人们常采用在其表面涂刷矿物油或镀上其他金属等覆盖保护层的方法。这些方法都能防止锈蚀的原理是______________。