题目内容
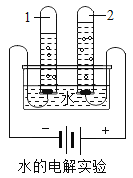
【题目】国家环保总局已规定将各类实验室纳入环保监管范围。某中学九年级甲、乙两个班的同学分别做常见酸和碱与指示剂反应的实验,所做的实验和使用的试剂如图所示。实验后废液分别集中到各班的废液缸中,甲班废液呈红色,乙班废液呈蓝色。
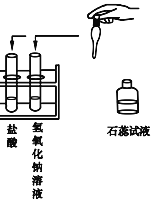
(1)请你分析废液的成分:甲班废液含有_____;乙班废液中含有_____。
(2)目前许多高校、中学以及科研单位的化学实验室排放的各类废液大都未经严格处理便进入了下水道。甲班的废液若直接排入铁管下水道,会腐蚀下水道,你建议可用_____试剂来处理,原理:_____。(用化学方程式表示)
【答案】NaCl、HCl NaCl、NaOH 碱性物质(或乙班废液) HCl+NaOH=NaCl+H2O
【解析】
(1)废液集中会发生中和反应,即氢氧化钠和盐酸反应生成氯化钠和水。甲班的废液显红色说明了存在盐酸,就不存在氢氧化钠,废液是经过中和反应的,所以含有氯化钠,故填写:NaCl、HCl;
乙班的废液显蓝色,说明了含有碱,一定存在氢氧化钠,不存在盐酸,废液是经过中和反应的,所以含有氯化钠,故填写:NaCl、NaOH;
(2)酸会与金属反应而将铁管下水道腐蚀,可以用乙班的碱性废液进行处理后再排放,故填写:碱性物质(或乙班废液);
盐酸与氢氧化钠反应生成氯化钠和水,故填写:HCl+NaOH=NaCl+H2O。

【题目】根据表中内容回答下列问题。
| 0 | 20 | 40 | 60 | 80 |
KNO3 | 13.3 | 31.6 | 63.9 | 110 | 169 |
NaCl | 35.7 | 36.0 | 36.6 | 37.3 | 38.4 |
Ca(OH)2 | 0.173 | 0.165 | 0.121 | 0.116 | 0.094 |
(1)将接近饱和的澄清石灰水变为饱和,除增加溶质的方法以外,还可以通过___、____达到。
(2)根据上表推断硝酸钾与氯化钠溶解度相等时的温度范围是____。
(3)向20℃的氢氧化钙饱和溶液中加入少量生石灰,再冷却至20℃,此时溶液中溶质的质量比加入生石灰前溶液中溶质的质量____(填“增大”、“不变”或“减小”)。
(4)20℃时,氯化钠饱和溶液中溶质的质量分数为____(结果保留至0.1%)。
【题目】某兴趣小组对KClO3分解反应的催化剂进行探究,在相同的加热条件下,用如图装置完成表中实验:
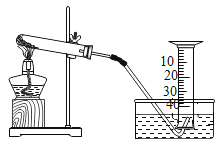
编号 | KClO3质量/g | 催化剂 | 催化剂质量/g | 收集50 mLO2所需时间/s |
实验1 | 5 | ﹣ | ﹣ | 171 |
实验2 | 5 | MnO2 | 0.5 | 49 |
实验3 | 5 | Fe2O3 | 0.5 | 58 |
实验4 | 5 | KCl | 0.5 | 154 |
(1)设置实验1的目的是______________。
(2)表中所列3种催化剂的催化效果最佳的是______________(填物质名称),该物质为_____________色固体。写出KClO3在该物质催化下受热分解的符号表达式:__________________。
(3)KClO3中Cl元素的化合价为_______________,试写出KClO3中的阴离子_____________。
(4)由实验1和实验4可知,KCl__________(填“有”或“无”)催化作用。维持加热条件不变,用实验1再继续收集50 mL O2,所需时间明显少于171 s,解释原因:______________。
(5)要比较KClO3分解反应中不同催化剂的催化效果,除了测量收集50 mL O2所需时间外,还可以测量相同时间内_____________。