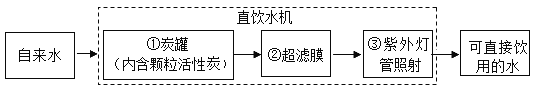
题目内容
【题目】我国具有丰容的硒资源。研究发现,硒(Se)对中风的营养和治疗有重要意义。图(a)是元素周期表的一部分。图(b)是硒元素原子的结构示意图,请根据要求填空:

(1)硒属于第_____周期。
(2)图中X=_____。
(3)硒和硫元素化学性质相似,都能形成阴离子。硒的阴离子符号为,_____
(4)请写出11号元素和16号元案所形成的化合物的化学式:_____
【答案】四 6 Se2- Na2S
【解析】
(1)由硒元素原子的结构示意图可知,硒元素原子核外电子层数为4,则硒属于第四周期。
(2)原子核电荷数=核外电子数,图中X=34-2-8-18=6。
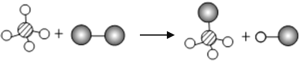
(3)硒和硫元素化学性质相似,都能形成阴离子,硫离子为![]() ,则硒的阴离子符号为
,则硒的阴离子符号为![]() ;
;
(4)11号元素为钠元素,16号元素为硫元素,它们所形成的化合物为硫化钠,化学式为:![]() 。
。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
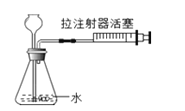
小学生10分钟应用题系列答案【题目】某实验小组对过氧化氢分解反应进行探究:
(探究一)探究影响过氧化氢分解快慢的因素。实验步骤及现象如下:
分别取5mLH2O2溶液进行实验,测定产生4mLO2所需时间,实验结果记录如下:
实验序号 | H2O2溶液的浓度 | 温度℃ | MnO2粉末用量/g | 反应时间 |
① | 30 | 35 | 0 | t1 |
② | 30 | 55 | 0 | t2 |
③ | 5 | 20 | 0.1 | t3 |
④ | 15 | 20 | 0.1 | t4 |
(1)对比①②两个实验,若t1>t2,则可得出的结论是:_____。
(2)能说明过氧化氢分解快慢与其浓度有关的实验是_____(填实验序号)。
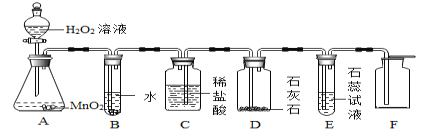
(探究二)探究氧化铁(Fe2O3)能否作过氧化氢溶液分解的催化剂?如果能,其催化效果如何?实验步骤及现象如下:
实验步骤 | 实验现象 |
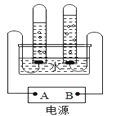
Ⅰ.分别量取5mL5%过氧化氢溶液放入A、B两支试管中,向A试管中加入0.5g氧化铁粉末,并将带火星的木条分别伸入A、B两支试管中,观察现象。 | A试管中产生大量气泡,带火星的木条复燃;_____ |
Ⅱ.待A试管中没有现象发生时,重新加入过氧化氢溶液,并把火星的木条伸入试管中,观察现象。 | 试管中产生大量气泡,带火星的木条复燃; |
Ⅲ.待实验Ⅱ中没有现象时,将试管中的反应剩余物过滤,并将滤渣洗涤、干燥、称量。 | 所得固体质量为_____g; |
Ⅳ.分别量取5mL5%过氧化氢溶液放入C、D两支试管中,向C试管中加入0.5g氧化铁粉末,向D试管中加入0.5g二氧化锰粉末,观察现象。 | —— |
(1)补充完成上述实验探究中表格的实验现象:①_____。②_____g。
(2)继续完成以下问题:
(实验结论)
①实验II、III证明_____。综上所述:氧化铁可以作过氧化氢分解的催化剂。
②写出氧化铁催化过氧化氢分解的符号表达式_____。
(实验评价)
③实验设计IV的目的是_____;
(实验拓展)
④查阅资料得知,氧化铜、硫酸铜、猪肝、马铃薯等也可以做过氧化氢溶液分解的催化剂。下列有关催化剂的说法中正确的是_____。
A 二氧化锰只能作过氧化氢溶液分解的催化剂
B 同一个化学反应可以有多种催化剂
C 催化剂只能加快化学反应的速率
D 用作催化剂的物质也可能是其他反应的反应物或生成物