题目内容
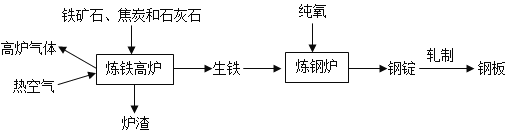
【题目】甲、乙、丙三种固体物质的溶解度曲线如图所示,回答下列问题:
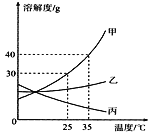
(1)25℃时,将20g甲固体加入到50g水中,充分溶解并恢复到原温度后,得到溶液的质量为____g。
(2)要使35℃时接近饱和的丙溶液变成该温度下的饱和溶液,可采用的一种方法是______。
(3)现有操作步骤:A.溶解B.过滤C.降温结晶D.加热浓缩。若甲固体中含有少量乙,则提纯甲的操作步骤的顺序是___________(填字母序号)。
(4)若将35℃时甲的饱和溶液降温到25℃,则其溶液的溶质质量分数会___。(填“变大”“变小”或“不变”)
【答案】130 加溶质或蒸发溶剂 ADCB B
【解析】
(1)25℃时,甲物质的溶解度是30g,将50g甲固体加入到100g水中,充分溶解并恢复到原温度后,得到溶液的质量=30g+100g=130g;
(2)要使35℃时接近饱和的丙溶液变成该温度下的饱和溶液,可采用的方法是:加溶质、蒸发溶剂;
(3)若甲固体中含有少量乙,则提纯甲的操作步骤是:A.溶解;D.加热浓缩;C.降温结晶;B.过滤;
(4)若将35℃时甲的饱和的溶液降温到变成25℃,则其溶液的溶质质量分数会变小,因为甲固体物质的溶解度,是随温度升高而增大的。

【题目】除去物质中的少量杂质,下列实验方法能达到实验目的是( )
实验目的 | 实验方法 | |
A | 除去铜粉中混有的少量碳粉 | 在空气中充分灼烧 |
B | 除去 | 加入过量的铁粉、过滤 |
C | 除去氯化钾中的少量氯酸钾 | 加入少量二氧化锰,并加热 |
D | 除去 | 将气体通过足量灼热的氧化铜 |
A. AB. BC. CD. D
【题目】依据溶解度知识回答下列小题。
下表为NaOH、Na2CO3、NaCl、Ca(OH) 2分别在水中的溶解度(g)
t/°C | NaOH | Na2CO3 | NaCl | Ca(OH)2 |
10 | 51 | 12. 2 | 35. 8 | 0. 17 |
10℃时,向4只盛有100 g水的烧杯中分别加入40 g上述四种物质配成溶液,依据上表回答下列小题。
【1】上述溶液为不饱和溶液的是
A. Ca(OH) 2 溶液B. Na2CO3 溶液C. NaCl 溶液D. NaOH 溶液
【2】上述溶液中,溶质质量分数最大的是
A. Na2CO3 溶液B. NaOH 溶液C. NaCl 溶液D. Ca(OH) 2 溶液
【3】关于上述形成的Na2CO3溶液,下列说法正确的是
A. 溶质的质量为40 g
B. 溶液的质量为140 g
C. 该烧杯底部有未溶解的固体
D. 10℃时,100 gNa2CO3溶液里含有12.2 g碳酸钠
【4】下图为氯化钠、碳酸钠在水中的溶解度曲线。依据图像判断,下列说法正确的是

A. 碳酸钠的溶解度小于氯化钠的溶解度
B. 20℃时,氯化钠溶液的质量分数一定小于碳酸钠溶液
C. 30℃时,两种物质的饱和溶液中溶质质量相等
D. 将Na2CO3和NaCl均达到饱和的混合溶液,从40℃降温至20℃时,析出的固体物质主要是Na2CO3