题目内容
【题目】依据溶解度知识回答下列小题。
下表为NaOH、Na2CO3、NaCl、Ca(OH) 2分别在水中的溶解度(g)
t/°C | NaOH | Na2CO3 | NaCl | Ca(OH)2 |
10 | 51 | 12. 2 | 35. 8 | 0. 17 |
10℃时,向4只盛有100 g水的烧杯中分别加入40 g上述四种物质配成溶液,依据上表回答下列小题。
【1】上述溶液为不饱和溶液的是
A. Ca(OH) 2 溶液B. Na2CO3 溶液C. NaCl 溶液D. NaOH 溶液
【2】上述溶液中,溶质质量分数最大的是
A. Na2CO3 溶液B. NaOH 溶液C. NaCl 溶液D. Ca(OH) 2 溶液
【3】关于上述形成的Na2CO3溶液,下列说法正确的是
A. 溶质的质量为40 g
B. 溶液的质量为140 g
C. 该烧杯底部有未溶解的固体
D. 10℃时,100 gNa2CO3溶液里含有12.2 g碳酸钠
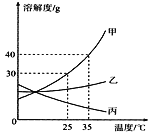
【4】下图为氯化钠、碳酸钠在水中的溶解度曲线。依据图像判断,下列说法正确的是

A. 碳酸钠的溶解度小于氯化钠的溶解度
B. 20℃时,氯化钠溶液的质量分数一定小于碳酸钠溶液
C. 30℃时,两种物质的饱和溶液中溶质质量相等
D. 将Na2CO3和NaCl均达到饱和的混合溶液,从40℃降温至20℃时,析出的固体物质主要是Na2CO3
【答案】
【1】D
【2】B
【3】C
【4】D
【解析】
【1】A、10℃时,Ca(OH)2的溶解度为0.17g,则向100g水的烧杯中加入40gCa(OH)2没有完全溶解,该溶液是饱和溶液,故错误;
B、10℃时,Na2CO3的溶解度为12.2g,则向100g水的烧杯中加入40gNa2CO3没有完全溶解,该溶液是饱和溶液,故错误;
C、10℃时,NaCl的溶解度为35.8g,则向100g水的烧杯中加入40gNaCl没有完全溶解,该溶液是饱和溶液,故错误;
D、10℃时,NaOH的溶解度为51g,则向100g水的烧杯中加入51gNaOH才能达到饱和状态,该溶液是不饱和溶液,故正确;
故选:D。
【2】10℃时,四种物质的溶解度中NaOH的最大,所以溶质质量分数最大的是NaOH溶液,
故选:B。
【3】10℃时,Na2CO3的溶解度是12.2g,
A、溶质的质量为12.2g,故说法错误;
B、溶液的质量为:100g+12.2g=112.2g,故说法错误;
C、溶质的质量为12.2g,则有27.8g溶质没有溶解,则该烧杯底部有未溶解的固体,故说法正确;
D、10℃时,112.2gNa2CO3溶液里含有12.2g碳酸钠,故说法错误;
故选:C。
【4】A、碳酸钠的溶解度小于氯化钠的溶解度错误,因为没有指明温度;故选项错误;
B、20℃时,氯化钠溶液的质量分数一定小于碳酸钠溶液错误,因为没有指明溶液的状态;故选项错误;
C、30℃时,两种物质的饱和溶液中溶质质量相等错误,因为没有指明是等质量的饱和溶液;故选项错误;
D、将Na2CO3和NaCl均达到饱和的混合溶液,从40℃降温至20℃时,析出的固体物质主要是Na2CO3正确,因为碳酸钠的溶解度受温度的影响变化比氯化钠大;故选项正确;
故选:D。

 教育世家状元卷系列答案
教育世家状元卷系列答案 黄冈课堂作业本系列答案
黄冈课堂作业本系列答案 单元加期末复习先锋大考卷系列答案
单元加期末复习先锋大考卷系列答案