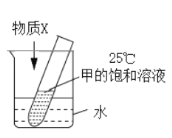
题目内容
【题目】某校化学兴趣小组的同学探究如何利用水垢制取氯化钙。水垢的主要成分是CaCO3和Mg(OH)2,由水垢制取氯化钙的流程如下:
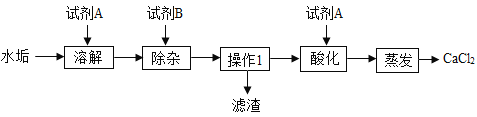
请回答:
(1)“试剂A”是一种酸,其化学式为_____。
(2)“试剂B”是氢氧化钙,所发生反应的化学方程式为_____;“试剂B”不能选用氢氧化钠,理由是_____。
(3)“酸化”的主要目的是_____。
(4)“操作1”中,需要用到的玻璃仪器除烧杯、玻璃棒外,还有_____。
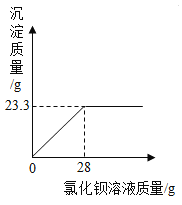
【答案】![]()
![]() 引入了新杂质 除去过量的氢氧化钙 漏斗
引入了新杂质 除去过量的氢氧化钙 漏斗
【解析】
利用水垢制取氯化钙,水垢的主要成分是CaCO3和Mg(OH)2,要除去Mg(OH)2并得到氯化钙,结合流程图和题干中信息可知,水垢中加入试剂A稀盐酸,水垢溶解,碳酸钙与稀盐酸反应生成氯化钙、二氧化碳和水,氢氧化镁与稀盐酸反应生成氯化镁和水,加入试剂B氢氧化钙除去杂质镁离子,氯化镁与氢氧化钙反应生成氢氧化镁沉淀和氯化钙,通过操作1过滤除去氢氧化镁,得到氯化钙和氢氧化钙的溶液,再加入试剂A稀盐酸酸化,氢氧化钙与稀盐酸反应生成氯化钙和水,蒸发氯化钙溶液得到氯化钙。
根据以上分析可知:
(1)“试剂A”是稀盐酸,其化学式为![]() 。
。
(2)“试剂B”是氢氧化钙,氯化镁与氢氧化钙反应生成氢氧化镁沉淀和氯化钙,反应的化学方程式为![]() ;“试剂B”不能选用氢氧化钠,理由是引入了新杂质。
;“试剂B”不能选用氢氧化钠,理由是引入了新杂质。
(3)“酸化”的主要目的是除去过量的氢氧化钙。
(4)“操作1”为过滤操作,需要用到的玻璃仪器除烧杯、玻璃棒外,还有漏斗。

练习册系列答案
相关题目