题目内容
【题目】某校化学兴趣小组为测定黄铜中锌的质量分数,进行如下实验:
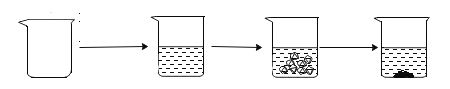
实验步骤 | ①称取烧杯的质量 | ②将适量盐酸加入烧杯中并称重 | ③称取黄铜样品加入烧杯中,使之与盐酸恰好完全反应 | ④特反应完全后,称重 |
实验图示 |
| |||
实验数据 | 烧杯的质量为50.0g | 烧杯和盐酸的质量为150.0g | 黄铜样品的质量为20.0g | 烧杯和其中混合物的量为169.6g |
涉及反应的化学方程式:Zn+2HCl==ZnCl2+H2↑请完成下列问题:
(1)步骤③可观察到的现象是:_____。
(2)该实验中生成的氢气的质量是_____g。
(3)求该黄铜样品中锌的质量分数。
【答案】(1)有气泡产生;(2)0.4g;(3)65%
【解析】
(1)锌和稀盐酸反应生成氢气,故填:有气泡生成;
(2)根据质量守恒定律可知,生成氢气的质量为150.0g+20.0g-169.6g=0.4g;
(3)设该黄铜样品中锌的质量分数为![]() 。
。
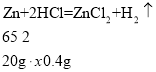
![]()
![]() = 65%
= 65%
答:黄铜样品中锌的质量分数为65%。

练习册系列答案
 海淀黄冈名师导航系列答案
海淀黄冈名师导航系列答案 普通高中同步练习册系列答案
普通高中同步练习册系列答案 优翼小帮手同步口算系列答案
优翼小帮手同步口算系列答案
相关题目
【题目】PLA是一种新型可降解塑料,能有效缓解塑料垃圾造成的白色污染。已知PLA由碳、氢、氧三种元素组成,为了测定7.2g PLA样品中氧元素的质量,某化学兴趣小组进行了以下探究。
(实验设计)查阅资料,无水硫酸铜遇水由白色变成蓝色。
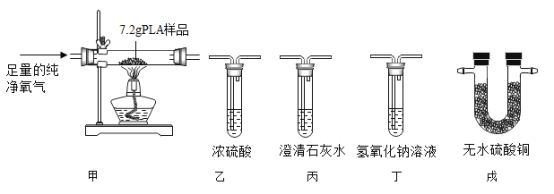
将7.2g PLA样品充分燃烧,分别吸收燃烧产物并通过清晰可见的现象检验吸收是否完全,正确连接装置,测得实验数据如下表:
装置 | 乙 | 丙 | 丁 | 戊 |
实验前质量/g | 160 | 150 | 150 | 100 |
实验后质量/g | 163.6 | 150 | 163.2 | 100 |
有关该实验,下列说法正确的是( )
A.装置正确的连接顺序是:甲→乙→丙→丁→戊
B.实验中干燥纯净的氧气可以换成干燥的空气
C.7.2g PLA样品中含有3.2g 氧元素
D.PLA中碳氢元素的原子个数比为9:1