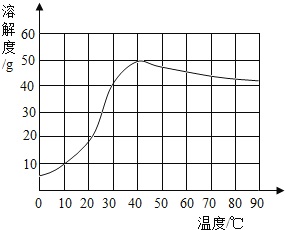
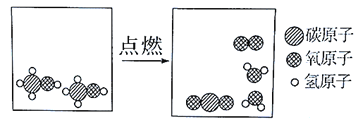
题目内容
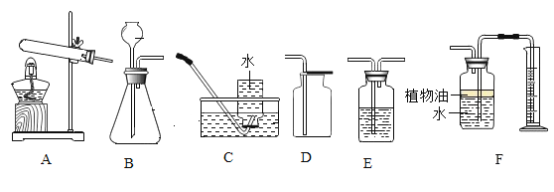
【题目】下图是实验室制备气体的部分装置。
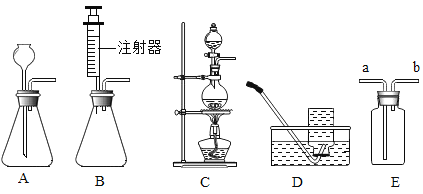
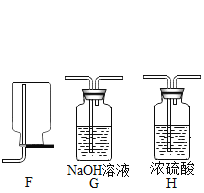
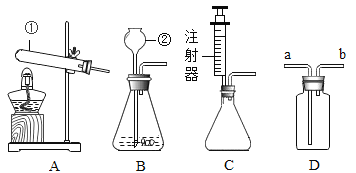
(1)上图装置可以制取不同气体,请完成下表空格。
反应物和反应条件 | 制取的气体 | 发生装置(填字母) | 收集装置(填字母) |
①H2O2溶液和MnO2固体,常温 | _____ | A或B | _____或E |
②亚硫酸钠(Na2SO3)固体和浓硫酸,常温 | SO2 | _____ | E |
③甲酸(HCOOH)和浓硫酸,加热 | CO | _____ | D |
(2)用A装置制取O2时,反应的化学方程式为_____,若要得到干燥的O2,所选择装置的连接顺序为:A→_____→E(填字母序号)。
(3)用E装置收集SO2时,气体应由(填“a”或“b”)_____端进入。
【答案】O2 D A或B C 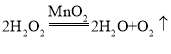 H a
H a
【解析】
(1)①过氧化氢溶液能在二氧化锰的催化下反应生成水和氧气,故制取的气体是O2;
氧气不溶于水,密度比空气大,可用排水法或向上排空气法收集,故收集装置应选D或E,故填:D;
②亚硫酸钠(Na2SO3)固体和浓硫酸,常温条件下制取二氧化硫,该反应属于固液不加热反应,发生装置应选A或B;
③甲酸(HCOOH)和浓硫酸,加热的条件下制取一氧化碳,该反应属于液体加热反应,发生装置应选C;
(2)A装置适用于过氧化氢溶液在二氧化锰的催化下制取氧气,该反应的化学方程式为: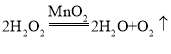 ;
;
浓硫酸具有吸水性,且不与氧气发生反应,可用浓硫酸来干燥氧气,要想得到干燥的氧气,应用向上排空气法收集,故若要得到干燥的O2,所选择装置的连接顺序为:A→H→E;
(3)二氧化硫的密度比空气大,用E装置收集SO2时,气体应由a端进入。

【题目】碳酸钠和碳酸氢钠是生活中常见的盐,通过实验验证、探究它们的化学性质.
(查阅资料)
①![]() ②
②![]()
③Ca(HCO3)2 易溶于水.
④CaCl2 溶液分别与 NaHCO3、Na2CO3 溶液等体积混合现象(表中的百分数为溶液中溶质的质量分数):
NaHCO3 | Na2CO3 | ||||
0.1% | 1% | 5% | 0.1% | ||
CaCl2 | 0.1% | 无明显现象 | 有浑浊 | 有浑浊 | 有浑浊 |
1% | 无明显现象 | 有浑浊 | 有浑浊,有微小气泡 | 有沉淀 | |
5% | 无明显现象 | 有浑浊 | 有浑浊,有大量气泡 | 有沉淀 | |
(进行实验)
序号 | 实验装置 | 主要实验步骤 | 实验现象 |
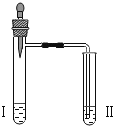
实验 1 |
| 向 2 支试管中分别加入少量 Na2CO3 和 NaHCO3溶液,再分别滴加盐酸 | 2 支试管中均有气泡产生 |
实验 2 |
| 向Ⅱ中加入试剂 a,向Ⅰ中加入少量Na2CO3或 NaHCO3固体,分别加热一段时间 | Na2CO3 受热时Ⅱ中无明显现象; NaHCO3 受热时Ⅱ中出现浑浊 |
实验 3 |
| 向Ⅱ中加入试剂 a,向Ⅰ中加入少量 5%的 NaHCO3溶液,再滴加 5%的 CaCl2溶液 | Ⅰ中出现_______; Ⅱ中出现_____。 |
(解释与结论)
(1)实验1中,NaHCO3与盐酸反应的化学方程式为:_________.
(2)实验2中,试剂a为__________.
(3)实验3中,NaHCO3与CaCl2反应的化学方程式为_______ .
(反思与评价)
(1)实验2中,加热NaHCO3后,试管Ⅰ中残留固体成分可能为____(写出所有可能).
(2)资料④中,NaHCO3溶液与CaCl2溶液混合的现象中,有些只观察到浑浊、未观察到气泡,原因可能是_____.
(3)请写出1种鉴别Na2CO3和NaHCO3固体的方法:_____