题目内容
【题目】实验室现有石灰石、高锰酸钾、稀盐酸等药品及相关仪器和用品,请结合下列装置回答问题:
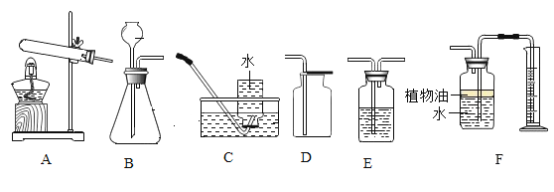
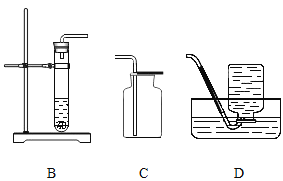
(1)利用现有仪器和药品制取氧气,还需要补充的一种用品为_________,补充此用品后便可以制取氧气了,发生反应的化学方程式为__________________________。从水槽中取出盛满氧气的集气瓶________(选填“正”或“倒”)放在实验台上。
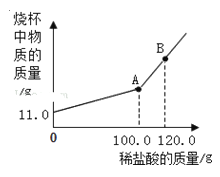
(2)欲制取二氧化碳气体,需要选择的发生装置是_________(填字母),一般用 D 装置收集二氧化碳,如果 E、D 相连共同使用,可收集到干燥的二氧化碳,则 E 装置内应盛有的液体是_______。也可以用 F 装置收集二氧化碳,随着反应的进行,装置内气体量不断增多,__________,大于外界大气压,在压强差的作用下,水被排出,瓶内收集到二氧化碳。若 F 装置内不含有植物油,则收集的二氧化碳气体的体积比真实制得气体的体积_______(选填“大”或“小”)。用量筒盛接水的目的是:通过盛接的量筒内水的体积,可以测得_________________________。
【答案】棉花 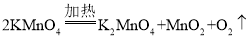 正 B 浓硫酸 压强增大 小 生成二氧化碳的体积
正 B 浓硫酸 压强增大 小 生成二氧化碳的体积
【解析】
(1)利用现有仪器和药品制取氧气,可用加热高锰酸钾的方法,需要在试管口塞一团棉花,还需要补充的一种用品为棉花,补充此用品后便可以制取氧气了,加热高锰酸钾反应生成锰酸钾、二氧化锰和氧气,发生反应的化学方程式为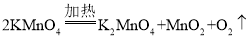 。氧气密度比空气大,从水槽中取出盛满氧气的集气瓶正放在实验台上。
。氧气密度比空气大,从水槽中取出盛满氧气的集气瓶正放在实验台上。
(2)欲制取二氧化碳气体,使用石灰石与稀盐酸反应,属于固液混合不需加热型,需要选择的发生装置是B,一般用 D 装置收集二氧化碳,如果 E、D 相连共同使用,可收集到干燥的二氧化碳,则 E 装置内应盛有的液体是浓硫酸,浓硫酸具有干燥作用。也可以用 F 装置收集二氧化碳,随着反应的进行,装置内气体量不断增多,压强增大,大于外界大气压,在压强差的作用下,水被排出,瓶内收集到二氧化碳。若 F 装置内不含有植物油,则收集的二氧化碳气体的体积比真实制得气体的体积小,因为二氧化碳溶于水并与水反应。用量筒盛接水的目的是:通过盛接的量筒内水的体积,可以测得生成二氧化碳的体积。

【题目】下图是实验室制备气体的部分装置。
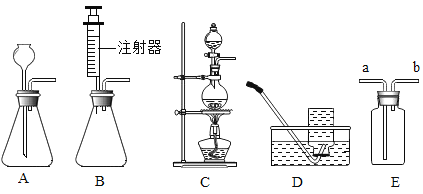
(1)上图装置可以制取不同气体,请完成下表空格。
反应物和反应条件 | 制取的气体 | 发生装置(填字母) | 收集装置(填字母) |
①H2O2溶液和MnO2固体,常温 | _____ | A或B | _____或E |
②亚硫酸钠(Na2SO3)固体和浓硫酸,常温 | SO2 | _____ | E |
③甲酸(HCOOH)和浓硫酸,加热 | CO | _____ | D |
(2)用A装置制取O2时,反应的化学方程式为_____,若要得到干燥的O2,所选择装置的连接顺序为:A→_____→E(填字母序号)。
(3)用E装置收集SO2时,气体应由(填“a”或“b”)_____端进入。
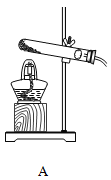
【题目】为验证质量守恒定律,某学习小组做了镁条在空气中燃烧的实验(图1)。
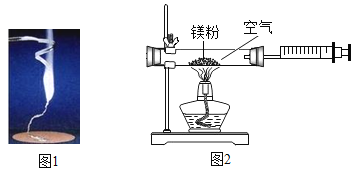
(1)请写出镁条与氧气反应的化学方程式_________________。
(2)小明认为根据质量守恒定律,燃烧产物的质量应大于反应物镁条的质量。镁条完全燃烧后,称量发现石棉网上的燃烧产物质量反而比反应前镁条质量小,其主要原因是______________。
(3)小红按图2装置改进实验,验证了质量守恒定律,却发现产物中还有一些黄色固体。
[查阅资料]①氧化镁为白色固体;
②镁能与氮气反应生成黄色的氮化镁(Mg3N2) 固体;
③氮化镁可与水反应生成氨气,氨气能使酚酞溶液变红。
[提出问题]黄色固体是什么呢?
[做出猜想]黄色固体为Mg3N2
[实验探究]
实验操作 | 实验现象及结论 |
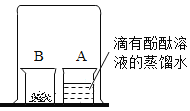
如图,取燃烧产物中的黄色固体于烧杯B中,加入适量水,然后用大烧杯罩住小烧杯A和B。
| 现象:____________。 结论:燃烧产物中含Mg3N2 |
[反思与交流]
空气中N2的含量远大于O2的含量,而镁条在空气中燃烧生成的MgO却远多于Mg3N2,请给出合理的解释______________。
[拓展延伸]
①根据题意,2.40g 镁条在空气中完全燃烧,所得固体质量为m,则m的取值范围____________。
②反思实验探究过程,谈谈你对物质燃烧条件的新认识__________。