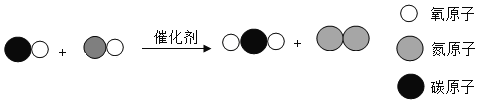
题目内容
【题目】碳酸钠和碳酸氢钠是生活中常见的盐,通过实验验证、探究它们的化学性质.
(查阅资料)
①![]() ②
②![]()
③Ca(HCO3)2 易溶于水.
④CaCl2 溶液分别与 NaHCO3、Na2CO3 溶液等体积混合现象(表中的百分数为溶液中溶质的质量分数):
NaHCO3 | Na2CO3 | ||||
0.1% | 1% | 5% | 0.1% | ||
CaCl2 | 0.1% | 无明显现象 | 有浑浊 | 有浑浊 | 有浑浊 |
1% | 无明显现象 | 有浑浊 | 有浑浊,有微小气泡 | 有沉淀 | |
5% | 无明显现象 | 有浑浊 | 有浑浊,有大量气泡 | 有沉淀 | |
(进行实验)
序号 | 实验装置 | 主要实验步骤 | 实验现象 |
实验 1 |
| 向 2 支试管中分别加入少量 Na2CO3 和 NaHCO3溶液,再分别滴加盐酸 | 2 支试管中均有气泡产生 |
实验 2 |
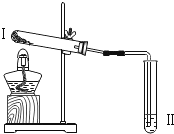
| 向Ⅱ中加入试剂 a,向Ⅰ中加入少量Na2CO3或 NaHCO3固体,分别加热一段时间 | Na2CO3 受热时Ⅱ中无明显现象; NaHCO3 受热时Ⅱ中出现浑浊 |
实验 3 |
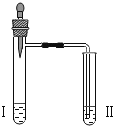
| 向Ⅱ中加入试剂 a,向Ⅰ中加入少量 5%的 NaHCO3溶液,再滴加 5%的 CaCl2溶液 | Ⅰ中出现_______; Ⅱ中出现_____。 |
(解释与结论)
(1)实验1中,NaHCO3与盐酸反应的化学方程式为:_________.
(2)实验2中,试剂a为__________.
(3)实验3中,NaHCO3与CaCl2反应的化学方程式为_______ .
(反思与评价)
(1)实验2中,加热NaHCO3后,试管Ⅰ中残留固体成分可能为____(写出所有可能).
(2)资料④中,NaHCO3溶液与CaCl2溶液混合的现象中,有些只观察到浑浊、未观察到气泡,原因可能是_____.
(3)请写出1种鉴别Na2CO3和NaHCO3固体的方法:_____
【答案】有浑浊,有大量气泡 澄清石灰水变浑浊 ![]() 澄清的石灰水
澄清的石灰水 ![]() ①Na2CO3;②Na2CO3和NaHCO3 CaCl2溶液的溶质质量分数较小,生成的CO2量较少,CO2溶于水,因此没有气泡 ①各取少量0.1%的 NaHCO3和Na2CO3加入等量的5%的CaCl2溶液,若无明显现象,则为NaHCO3,若观察到浑浊则为Na2CO3;
①Na2CO3;②Na2CO3和NaHCO3 CaCl2溶液的溶质质量分数较小,生成的CO2量较少,CO2溶于水,因此没有气泡 ①各取少量0.1%的 NaHCO3和Na2CO3加入等量的5%的CaCl2溶液,若无明显现象,则为NaHCO3,若观察到浑浊则为Na2CO3;
②各取少量Na2CO3和NaHCO3固体于实验2装置中,分别加热一段时间,若观察到澄清石灰水变浑浊,固体为NaHCO3,若观察到无明显现象,固体为Na2CO3.
【解析】
由题意,结合实验3的实验装置图和操作步骤可知,试剂a为澄清石灰水,5%的NaHCO3溶液与5%的CaCl2溶液反应的实验现象为有浑浊,有大量气泡,即为Ⅰ中出现的现象;二氧化碳与氢氧化钙反应生成碳酸钙沉淀和水,Ⅱ中出现的现象为澄清石灰水变浑浊。
解释与结论:
(1)碳酸氢钠和盐酸反应生成氯化钠、水和二氧化碳,反应的化学方程式为![]() ;
;
(2)实验2是为检验碳酸钠和碳酸氢钠的热稳定性,所以实验中的实验步骤是加热并将产生的气体通入澄清的石灰水中,试剂a为澄清石灰水;
(3)由题干中资料可知NaHCO3与 CaCl2反应生成气体和沉淀,气体为二氧化碳,沉淀为碳酸钙,还有氯化钠和水生成,反应的化学方程式为![]() ;
;
反思与评价:
(1)NaHCO3完全分解时,试管Ⅰ中残留固体成分为Na2CO3,没有完全分解时残留固体成分为Na2CO3、NaHCO3;
(2)NaHCO3溶液与CaCl2溶液混合的现象中,有些只观察到浑浊、未观察到气泡,对比表格中信息可发现原因可能是CaCl2溶液的溶质质量分数较小,生成的CO2量较少,CO2溶于水,因此没有气泡;
(3)根据实验探究可以用5%的 CaCl2溶液或加热分解的方法来鉴别Na2CO3和NaHCO3固体,操作如下:
①各取少量0.1%的NaHCO3和Na2CO3加入等量的5%的CaCl2溶液,若无明显现象,则为NaHCO3,若观察到浑浊则为Na2CO3;
②各取少量Na2CO3和NaHCO3固体于实验2装置中,分别加热一段时间,若观察到澄清石灰水变浑浊,固体为NaHCO3,若观察到无明显现象,固体为Na2CO3.

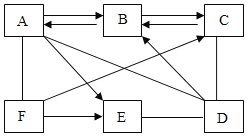
【题目】下图中直线相连物质间在一定条件下可以发生反应。下表提供的四组物质符合图中要求的是( )
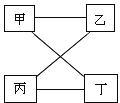
甲 | 乙 | 丙 | 丁 | |
A | Ca(OH)2 | CO2 | NaOH | CuSO4 |
B | Na2CO3 | BaCl2 | HCl | Ca(OH)2 |
C | Zn | HCl | CuCl2 | NaOH |
D | H2 | O2 | HCl | CuO |
A.AB.BC.CD.D
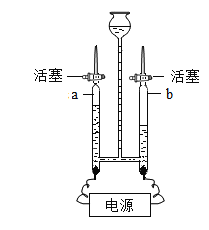
【题目】下图是实验室制备气体的部分装置。
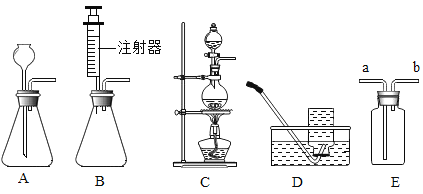
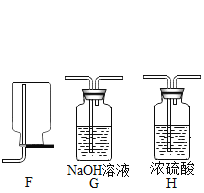
(1)上图装置可以制取不同气体,请完成下表空格。
反应物和反应条件 | 制取的气体 | 发生装置(填字母) | 收集装置(填字母) |
①H2O2溶液和MnO2固体,常温 | _____ | A或B | _____或E |
②亚硫酸钠(Na2SO3)固体和浓硫酸,常温 | SO2 | _____ | E |
③甲酸(HCOOH)和浓硫酸,加热 | CO | _____ | D |
(2)用A装置制取O2时,反应的化学方程式为_____,若要得到干燥的O2,所选择装置的连接顺序为:A→_____→E(填字母序号)。
(3)用E装置收集SO2时,气体应由(填“a”或“b”)_____端进入。