题目内容
【题目】有一包白色固体样品,可能含有CuSO4、NaOH、Na2CO3、K2SO4、BaCl2中的一种或几种,为确定其组成,进行如下图所示实验:
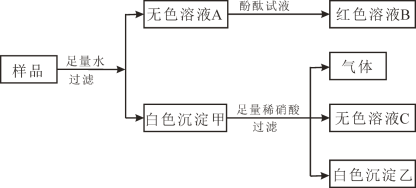
根据上述实验,回答下列问题:
(1)加入稀硝酸产生的气体是__________________。
(2)白色沉淀甲的成分是________________________________。
(3)实验中反应生成白色沉淀乙的化学方程式为____________________________________。
(4)原白色固体样品中不能确定是否存在的物质是__________________。
【答案】CO2 BaSO4、BaCO3 (写对一种得1分,多写不得分) ![]() NaOH
NaOH
【解析】
样品中加入足量水溶解,产生无色溶液A和白色沉淀甲,说明样品中没有硫酸铜,因为硫酸铜溶液是蓝色,氢氧化铜沉淀是蓝色的;无色溶液A滴入酚酞试液变红色,说明溶液A显碱性;白色沉淀甲加入足量的稀硝酸产生气体和无色溶液C以及白色沉淀乙,硫酸钡不能溶于稀硝酸,则白色沉淀乙是硫酸钡,碳酸钡沉淀能与稀硝酸反应产生硝酸钡溶液和二氧化碳气体,说明白色沉淀中一定有碳酸钡和硫酸钡;
(1)白色沉淀甲中的碳酸钡与加入的稀硝酸反应产生的气体是:二氧化碳(CO2)。
(2)白色沉淀甲的成分是:碳酸钡(BaCO3)和硫酸钡(BaSO4)的混合物。
(3)实验中氯化钡与硫酸钾反应产生氯化钾和硫酸钡沉淀的化学方程式为:![]() ;
;
(4)原白色固体样品中不能确定是否存在的物质是:氢氧化钠,因为:氢氧化钠溶液显碱性,碳酸钠溶液同样显碱性,无色溶液A滴入酚酞试液变红色,说明溶液A显碱性,样品中一定有碳酸钠,不能确定是否有氢氧化钠。

练习册系列答案
 口算能手系列答案
口算能手系列答案
相关题目