题目内容
【题目】2020年春节,新型冠状病毒来袭,走情访友已成奢望。然而,冠状病毒在环境里并不是无坚不摧,75%的乙醇(医用酒精)、含氯的消毒剂(84消毒液)、20%的过氧乙酸等均可有效杀灭病毒。下列关于过氧乙酸(分子式C2H4O3)的说法中错误的是( )

A.过氧乙酸属于有机化合物
B.过氧乙酸是由分子构成的
C.过氧乙酸中氧元素的质量分数最高
D.过氧乙酸中碳、氧元素的质量比为2:3
【答案】D
【解析】
A、过氧乙酸中含有碳、氢、氧三种元素,属于有机化合物;故选项正确,但不符合题意;
B、过氧乙酸是由过氧乙酸分子构成的;故选项正确,但不符合题意;
C、过氧乙酸中碳、氢、氧三种元素的的质量比为24:4:48,氧元素的质量占比最大,其质量分数最高;故选项正确,但不符合题意;
D、过氧乙酸中碳、氧元素的质量比为24:48=1:2;故选项错误,但符合题意;
故选:D。

【题目】铜及铜的化合物在生产、生活中有着广泛的应用。
(一)铜的广泛应用
(1)我国在西汉时期就有“曾青得铁则化为铜”之说,用化学方程式表示其原理______。
(2)铜在工业上可用于生产电缆(外面包裹了电缆皮),这是利用了铜的_____性。
(二)硫酸铜晶体的制备
工业上用含铜废料(如:碎铜、电缆皮等)。某化学小组的同学提出可以用含铜废料制备硫酸铜晶体(CuSO4·xH2O).主要流程如下:
![]()
(1)含铜废料粉碎的目的是__________。
(2)该流程中,加入H2O2后要求温度控制在50℃到60℃加热的原因为_____。
(3)兴趣小组同学一致指出,将滤液经蒸发浓缩、_____(填结晶方法)、过滤等操作后,用少量95%的酒精淋洗后晾干,得硫酸铜晶体(CuSO4·xH2O),晶体采用酒精淋洗而不用水的原因是____________。
(三)铜生锈会生成碱式碳酸铜,而工业上所制得的碱式碳酸铜种类较多,其组成表示为:xCuCO3·yCu(OH)2·zH2O。
资料:xCuCO3·yCu(OH)2·zH2O加热至200时会分解得到氧化铜,二氧化碳和水。
测定某种产品的组成,该兴趣小组准确称量了25.8g的样品,设计了如下装置并进行实验:
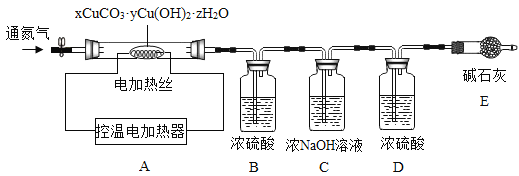
实验数据记录如下表:
B中溶液质量/g | C中溶液质量/g | D中溶液质量/g | E中固体质量/g | |
反应前 | 100.0 | 100.0 | 100.0 | 120.5 |
反应后 | 105.4 | 104.4 | 100.2 | 120.5 |
实验分析和数据处理
(1)实验前应该先_________,再鼓入一段时间氮气后称量B、C、D、E的质量。
(2)停止鼓入氮气,调控温电加热220℃持续加热,观察到装置B中______时表明碱式碳酸铜已经完全分解。
(3)反应结束后,再缓缓鼓入一段时间氮气的目的是___________。
(4)该碱式碳酸铜的化学式是__________。
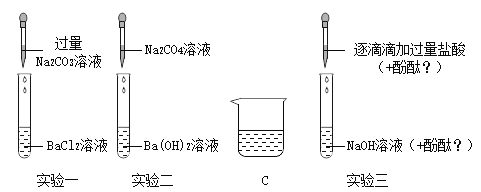
【题目】同学们用碳酸钠溶液和盐酸的反应验证质量守恒定律,实验后他们对残留废液的成分进行探究。
(推理假设)
上述两种物质发生反应的化学方程式为__________,由此推测出废液中一定有NaCl,可能有___________。
(实验探究)
(1)确定废液中是否含有盐酸:
①选择试剂:根据盐酸的化学性质,同学们选用了如图所示的五种物质,其中物质X是酸碱指示剂中的_________溶液。
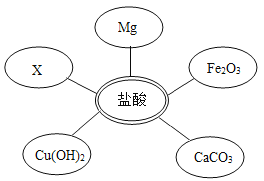
②实验验证:某同学向废液中加入少量的镁粉,观察到______________,确定废液中一定没有盐酸。
(2)确定废液中是否含有Na2CO3:某同学选用_________测出废液的pH=l0,确定废液中一定含有Na2CO3。
(3)处理废液,回收利用:欲从废液中得到纯净的NaCl,请完成如下实验方案设计。
方案 | 加入试剂 | 提纯的方法 | 方案评价 |
一 | 适量Ca(NO3)2溶液 | 过滤、蒸发结晶 | _______(选填可行或不可行) |
二 | 稍过量的________ | ________ | 可行 |
(4)拓展运用:
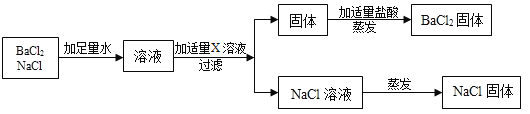
按如下图方案分离BaCl2和NaCl的固体混合物时,X溶液中溶质是___________。
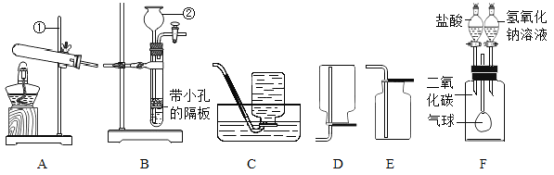
【题目】某小组进行了如下实验,请回答下列问题。
序号 | 甲 | 乙 | 丙 |
实验 |
|
|
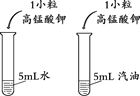
a、c为干燥的紫色石蕊试纸 b、d为湿润的紫色石蕊试纸 |
(1)甲实验的目的是________。
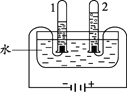
(2)乙实验,若电解18g 水,则试管2内得到的气体质量为_____g 。
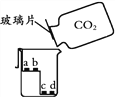
(3)丙实验,说明二氧化碳密度大于空气且能与水反应的现象是________________。