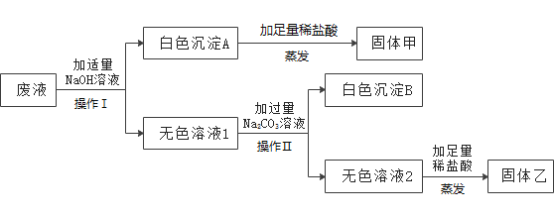
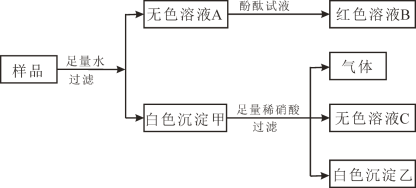
题目内容
【题目】元素周期表是学习和研究化学的重要工具。
(1)原子序数为1~18的元素在元素周期表中的位置如下表所示。

①Al属于_________(填“金属”或“非金属”)元素,其原子的核电荷数为__________。
②Na原子的结构示意图为 ,则钠离子的核外电子数为________。
,则钠离子的核外电子数为________。
③周期表中硫元素的有关信息如图所示,图中“32.06”所表示的含义是________________。
![]()
④由钠和硫构成的盐的化学式为_____________。
(2)根据周期表体现的结构与性质之间的关系,某同学构建了铜及其化合物的“化合价—物质类别”关系图。
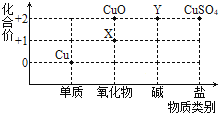
①写出物质X的化学式:_____________。
②写出由物质Y转化为CuSO4的化学反应方程式:_______________。
【答案】金属 13 10 硫的相对原子质量为32.06 Na2S Cu2O Cu(OH)2+H2SO4=CuSO4+2H2O
【解析】
(1)①Al属于金属元素,铝原子的质子数为13,质子数等于核电荷数,所以铝原子的核电荷数为13;
②Na原子的结构示意图为 ,最外层电子数为1,小于4个,易失去最外层电子数,则钠离子的核外电子数为10;
,最外层电子数为1,小于4个,易失去最外层电子数,则钠离子的核外电子数为10;
③图中“32.06”所表示的含义是硫原子的相对原子质量为32.06;
④钠和硫构成的盐是硫化钠,其化学式为Na2S;
(2)①X中铜元素的化合价为+1价,氧元素的化合价为-2价,物质X的化学式为:Cu2O;
②根据题意可知:Y是氢氧化铜,由物质Y转化为CuSO4的化学反应方程式为:Cu(OH)2+H2SO4=CuSO4+2H2O。

 培优口算题卡系列答案
培优口算题卡系列答案 开心口算题卡系列答案
开心口算题卡系列答案 口算题卡河北少年儿童出版社系列答案
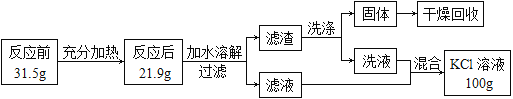
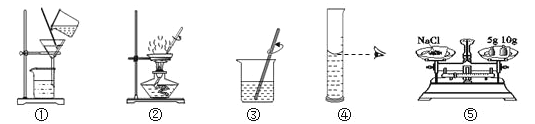
口算题卡河北少年儿童出版社系列答案【题目】请从A或B两题中任选一个作答,若两题均作答,按A计分。
A 配制160g 10%的氯化钠溶液 | B去除粗盐中的泥沙 |
(1)实验的主要步骤是:⑤→_____→③。 (2)溶解时,用玻璃棒搅拌的目的是_____。 | (1)实验的主要步骤是:③→_____→②。 (2)蒸发时,用玻璃棒搅拌的目的是_____。 |
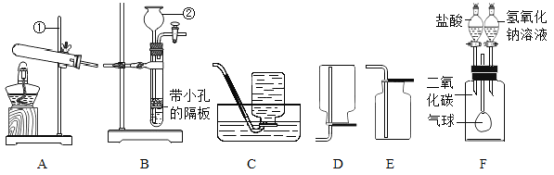
可供选择的基本实验操作如图:
| |