题目内容
【题目】水是生命之源“珍惜水、节约水、爱护水”是每个公民应尽的义务和责任。
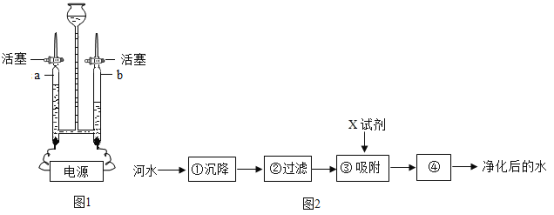
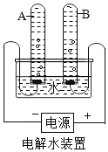
(1)用如图1所示装置进行电解水的实验,a、b两玻璃管中收集到的气体质量比为_______,反应的化学方程式为________,该实验证明水是由_______组成的。
(2)饮用硬度过大的水不利于人体键康,生活中可用________区分硬水和软水:
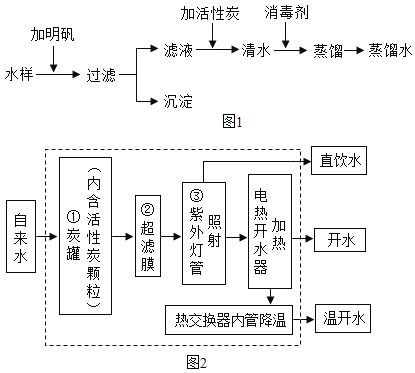
(3)如图2是自来水厂净化水的主要步骤。有关说法错误的是______(填字母):
A步骤①中可加入明矾作絮凝剂
BX试剂可以是活性炭
C步骤②的作用是消毒杀菌
D净化后的水为纯净物
(4)小英同学从河水中取出浑浊水样进行实验。将水样静置进行过滤,其操作规范是______(填序号)
a用玻璃棒引流
b滤纸边缘高出漏斗
c漏斗末端颈尖未紧靠烧杯内壁
d将滤纸湿润,使其紧贴漏斗内壁
e用玻璃棒在漏斗中轻轻搅动以加快过滤速度
(5)合理开发利用水资源。推进社会发展与进步。水作为原料,可获得多种产品。
①工业上常用水通入灼热的碳制取水煤气,水煤气是氢气和一氧化碳的混合气体,该反应原理为_________(写化学反应方程式)
②利用CO和H2制取二甲醚的微观过程如图所示:
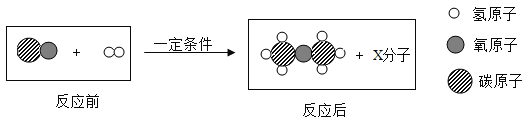
1个X分子中含有10质子。该变化过程中,参加反应的CO和H2的分子个数比是_________。
(6)为了人类的生存和发展,人类必须爱惜水。下列做法不利于保护水资源的是_________。
A生活污水直接排放
B提倡使用节水器具
C工业上冷却水重复利用
D园林浇灌用滴灌、喷灌
【答案】8:1 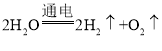 氢元素和氧元素 肥皂水 CD ad
氢元素和氧元素 肥皂水 CD ad 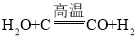 1:2 A
1:2 A
【解析】
(1)电解水时,正氧负氢,氢二氧一,用如图1所示装置进行电解水的实验,a、b两玻璃管中收集到的气体分别是氧气、氢气,它们的质量比为32:(2×2)=8:1,反应的化学方程式为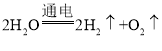 ,该实验证明水是由氢元素和氧元素组成的。
,该实验证明水是由氢元素和氧元素组成的。
(2)生活中可用肥皂水区分硬水和软水,出现泡沫多的是软水,出现泡沫少的是硬水:
(3)A 明矾溶于水生成的胶状物,能吸附水中的杂质,然后一同沉降,步骤①中可加入明矾作絮凝剂,此选项正确;
B 活性炭具有吸附性,可除去异味、色素,X试剂可以是活性炭,此选项正确;
C 步骤②是过滤,目的是除去难溶于水的固体物质,此选项错误;
D 净化后的水中仍含有一些可溶性的杂质,为混合物,此选项错误。故选CD。
(4)a 用玻璃棒引流液体至过滤器中,此选项正确;
b 滤纸边缘低于漏斗边缘,此选项错误;
c漏斗末端颈尖要紧靠烧杯内壁,以防液体溅出,此选项错误;
d将滤纸湿润,使其紧贴漏斗内壁,以防过滤速度太慢,此选项正确;
e 不能用玻璃棒在漏斗中搅动,此选项错误。故选ad。
(5)①工业上常用水通入灼热的碳制取水煤气,水煤气是氢气和一氧化碳的混合气体,该反应原理为: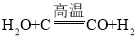
②1个X分子中含有10质子,则X是水,该反应的化学方程式为:2CO+4H2 C2H6O+ H2O,参加反应的CO和H2的分子个数比为1:2。
C2H6O+ H2O,参加反应的CO和H2的分子个数比为1:2。
(6)A 生活污水直接排放,会造成水污染,此选项符合题意;
B 提倡使用节水器具,可节约用水,此选项不符合题意;
C工业上冷却水重复利用,可节约用水,此选项不符合题意;
D园林浇灌用滴灌、喷灌,可节约用水,此选项不符合题意。故选A。

【题目】某兴趣小组同学利用下图所示装置进行“铝与硫酸铜溶液反应”的实验时,发现反应开始后试管中出现红色固体的同时产生无色无味气体,兴趣小组同学进行了以下探究:
实验1:向7支盛有相同体积、相同温度硫酸铜溶液的试管中,分别加入表面经过打磨处理的相同长度的铝条,现象如下:
实验组别 | ① | ② | ③ | ④ | ⑤ | ⑥ | ⑦ |
硫酸铜溶液浓度 | 24% | 12% | 8% | 6% | 5% | 3% | 1% |
气泡情况 | 很快 | 快 | 较快 | 快 | 较快 | 慢 | 无 |
实验2:向5支盛有相同体积、质量分数为8%硫酸铜溶液的试管中,分别加入表面经过打磨处理的相同长度的铝条,然后放在不同温度的水浴中(如图所示),现象如下:
实验组别 | ① | ② | ③ | ④ | ⑤ |
水浴温度(℃) | 20 | 30 | 40 | 50 | 60 | 产生气泡情况 | 较快 | 快 | 很快 | 很快 | 很快 |

(1)实验1的目的是______。
(2)实验2的结论是_____。
(3)依据实验1和实验2.推测50℃时5%硫酸铜溶液与铝条反应的现象是____。
(反思与评价)
(4)实验2没有进行温度为70℃的实验,理由是_____。
(5)根据你的猜想,气泡中的气体可能是_____。
【题目】某兴趣小组对KClO3分解反应的催化剂进行研究,在相同的加热条件下,用下图装置完成表中实验:
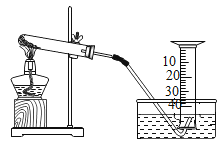
编号 | KClO3质量/g | 催化剂 | 催化剂质量/g | 收集50mLO2所需时间/s |
实验1 | 5 | - | - | 171 |
实验2 | 5 | MnO2 | 0.5 | 49 |
实验3 | 5 | Fe2O3 | 0.5 | 58 |
实验4 | 5 | KCl | 0.5 | 154 |
(1)设置实验1的目的是________。
(2)表中所列3种催化剂的催化效果最佳的是________。
(3)写出KC1O3分解的化学方程式:________。
(4)由实验1和实验4可知,KCl有催化作用。维持加热条件不变,用实验1再继续收集收集50mLO2,所需时间明显少于171s,解释原因:___________。
(5)要比较KClO3分解反应中不同催化剂的催化效果,除了测量收集50mLO2所需时间外,还可以测量相同时间内_____________。