题目内容
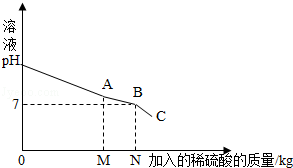
用氢氧化钠溶液测定某硫酸溶液溶质的质量分数.实验如下:取25g该硫酸溶液,加入到烧杯中,然后把50g质量分数为10%的氢氧化钠溶液不断滴入烧杯中,同时用电子PH计不断读取反应时的PH,得出如图所示的关系,求;

(1)该硫酸溶液溶质的质量分数.
(2)配制500g上述硫酸溶液,所需质量分数为98%的硫酸溶液的质量.

(1)该硫酸溶液溶质的质量分数.
(2)配制500g上述硫酸溶液,所需质量分数为98%的硫酸溶液的质量.
(1)19.6% (2)100g
试题分析:(1)当溶液的pH值等于7说明硫酸恰好和氢氧化钠溶液反应,此时消耗10%的氢氧化钠溶液40g.
设该硫酸溶液溶质的质量分数为x.
2NaOH+H2SO4=Na2SO4+2H2O
80 98
40g×10% 25g×x
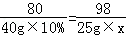
x=19.6%
答:该硫酸溶液溶质的质量分数为19.6%.
(2)设所需质量分数为98%的硫酸溶液的质量为y.
500g×19.6%=y×98%
y=100g
答:所需质量分数为98%的硫酸溶液的质量为100g.
点评:本题是有关化学方程式和溶质质量分数的简单计算.解题时要注意格式和步骤.

练习册系列答案
相关题目
 温度
温度