题目内容
某纯碱样品中含有杂质NaCl,为测定该样品中Na2CO3的质量分数,称取纯碱样品6 g,放入20 g水中使其完全溶解,再加入稀盐酸26.2 g,恰好完全反应,反应后溶液的总质量为50 g。
试计算:(写出计算过程,结果保留一位小数)
(1)生成二氧化碳的质量;
(2)样品中Na2CO3的质量分数;
(3)反应后所得溶液中溶质的质量分数。
试计算:(写出计算过程,结果保留一位小数)
(1)生成二氧化碳的质量;
(2)样品中Na2CO3的质量分数;
(3)反应后所得溶液中溶质的质量分数。
(1)产生CO2质量为2.2 g;
(2)样品中Na2CO3质量分数为88.3%;
(3)反应后所得溶液中溶质质量分数为13.1%。
(2)样品中Na2CO3质量分数为88.3%;
(3)反应后所得溶液中溶质质量分数为13.1%。
(1)根据质量守恒定律可知,生成CO2质量=20 g(水的质量)+6 g(固体质量)+26.2 g(稀盐酸的质量)-50 g(反应后溶液的总质量)=2.2 g
(2)已知二氧化碳的质量,未知碳酸钠的质量,可根据化学方程式中两物质的质量关系进行求解。
(3)反应后所得溶液为氯化钠溶液,溶质氯化钠包括两部分。一部分是原样品中含有的,可用原固体质量减去碳酸钠质量求得;另一部分为反应生成的氯化钠,可根据反应化学方程式中二氧化碳与其间的质量关系进行求解。
具体解题过程为:
(2)解:设Na2CO3的质量为x,生成氯化钠的质量为y 设未知量
Na2CO3+2HCl=2NaCl+CO2 ↑+H2O 写出反应的化学方程式
106 117 44 标出反应中物质的质量比
x y 2.2 g 标出已知、未知量
 列比例式
列比例式
 =5.3 g 求解未知量x
=5.3 g 求解未知量x
则样品中Na2CO3的质量分数=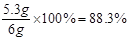
(3) 列比例式
列比例式
y=5.85 g 求解未知量y
反应后溶液中溶质NaCl的质量为:5.85 g+(6 g-5.3 g)=6.55 g
则反应后溶液中溶质质量分数=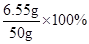 =13.3%
=13.3%
点评:根据化学方程式进行计算的关键有两点:1、反应的化学方程式;2、物质间的质量关系。格式要规范。
(2)已知二氧化碳的质量,未知碳酸钠的质量,可根据化学方程式中两物质的质量关系进行求解。
(3)反应后所得溶液为氯化钠溶液,溶质氯化钠包括两部分。一部分是原样品中含有的,可用原固体质量减去碳酸钠质量求得;另一部分为反应生成的氯化钠,可根据反应化学方程式中二氧化碳与其间的质量关系进行求解。
具体解题过程为:
(2)解:设Na2CO3的质量为x,生成氯化钠的质量为y 设未知量
Na2CO3+2HCl=2NaCl+CO2 ↑+H2O 写出反应的化学方程式
106 117 44 标出反应中物质的质量比
x y 2.2 g 标出已知、未知量
 列比例式
列比例式 =5.3 g 求解未知量x
=5.3 g 求解未知量x则样品中Na2CO3的质量分数=
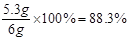
(3)
 列比例式
列比例式y=5.85 g 求解未知量y
反应后溶液中溶质NaCl的质量为:5.85 g+(6 g-5.3 g)=6.55 g
则反应后溶液中溶质质量分数=
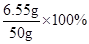 =13.3%
=13.3%点评:根据化学方程式进行计算的关键有两点:1、反应的化学方程式;2、物质间的质量关系。格式要规范。

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
 3Fe+4CO2.用100t含Fe3O480%的磁铁矿石,理论上冶炼含杂质4%的生铁多少?(答案保留一位小数)
3Fe+4CO2.用100t含Fe3O480%的磁铁矿石,理论上冶炼含杂质4%的生铁多少?(答案保留一位小数)