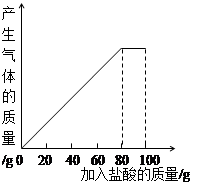题目内容
一块表面被氧化的铝片质量为15.6g,将其放入烧杯中,加入213g稀硫酸,恰好完全反应,反应后,称得烧杯中的溶液质量为228g,求:(提示:Al2O3+3H2SO4═Al2(SO4)3+3H2O 2Al+3H2SO4═Al2(SO4)3+3H2↑)
(1)生成氢气的质量为 g;
(2)反应后所得溶液中溶质的质量分数.
(1)生成氢气的质量为 g;
(2)反应后所得溶液中溶质的质量分数.
(1)0.6g (2)30%
试题分析:(1)根据质量守恒定律可知,反应前后减少的质量是生成氢气的质量,为:15.6g+213g﹣228g=0.6g;
(2)设铝片中铝的质量是x,生成的硫酸铝的质量为y
2Al+3H2SO4═Al2(SO4)3+3H2↑
54 342 6
x y 0.6g
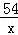 =
=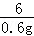 x=5.4g
x=5.4g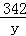 =
=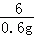 y=34.2g
y=34.2g所以铝片中氧化铝的质量为:15.6g﹣5.4g=10.2g
设氧化铝反应生成的硫酸铝的质量为a
Al2O3+3H2SO4═Al2(SO4)3+3H2O
102 342
10.2g a
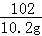 =
=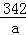
a=34.2g
反应后所得溶液中溶质的质量分数为:
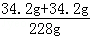 ×100%=30%
×100%=30%故答案为:(1)0.6g;(2)反应后所得溶液中溶质的质量分数为30%.
点评:本题考查了学生对于质量守恒定律的理解和应用,并能结合题目中化学反应原理灵活分析解答问题,尤其是反应后溶液中溶质的确定,要细心分析解答.

练习册系列答案
相关题目