题目内容
我们知道,每次做完实验后,剩余废液不能直接倾倒入排污管,必须回收处理.某班同学实验后收集到含有碳酸钠和氢氧化钠的混合废液5.11Kg,一个兴趣小组用废弃的溶质质量分数为19.6%的硫酸来处理,并回收处理后的溶液.他们向废液中加入稀硫酸时,所得溶液pH与加入的稀硫酸质量的关系曲线如图所示.求:
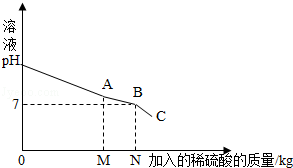
(1)通过如图可知,当反应进行至图中 点时(填“A”、“B”或“C”),废液恰好处理完(即碳酸钠和氢氧化钠混合废液刚好完全转化成硫酸钠溶液).
(2)当向混合液中加入稀硫酸至N点时,加入的稀硫酸质量为5Kg,此时溶液总质量为10Kg.求此时所得溶液中溶质的质量分数(写出计算过程,溶于水的气体忽略不计).

(1)通过如图可知,当反应进行至图中 点时(填“A”、“B”或“C”),废液恰好处理完(即碳酸钠和氢氧化钠混合废液刚好完全转化成硫酸钠溶液).
(2)当向混合液中加入稀硫酸至N点时,加入的稀硫酸质量为5Kg,此时溶液总质量为10Kg.求此时所得溶液中溶质的质量分数(写出计算过程,溶于水的气体忽略不计).
(1)B (2)14.2%
试题分析:(1)由于生成的硫酸钠溶液显中性,由图示可知,当反应进行至图中B点时,pH=7,然后又下降,说明此时恰好将废液处理完;
(2)设生成的硫酸钠的质量为x
由H2SO4+2NaOH═Na2SO4+2H2O、2NaOH+H2SO4=Na2SO4+2H2O
得:H2SO4~Na2SO4
98 142
5Kg×19.6% x

解得:x=1.42gKg
所得溶液中溶质的质量分数是:
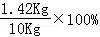 =14.2%.
=14.2%.答:(1)B;(2)所得溶液中溶质的质量分数是14.2%.
点评:在解此类题时,首先分析反应应用的原理,然后结合图象中的转折点,以及方程式中的比例关系进行解答.

练习册系列答案
相关题目


 2NaOH+ Cl2↑+ H2↑。现需要71t氯气用于自来水消毒,理论上需要含杂质10%的粗盐多少吨?同时生成烧碱多少吨?
2NaOH+ Cl2↑+ H2↑。现需要71t氯气用于自来水消毒,理论上需要含杂质10%的粗盐多少吨?同时生成烧碱多少吨?