题目内容
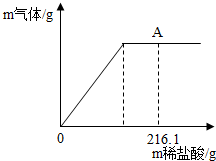 向盛有22.3g碳酸钠和氯化钠固体混合物的烧杯中逐滴加入质量分数为10%的稀盐酸,放出气体的质量与滴入稀盐酸的质量关系如图所示.反应结束后,A点氯化钠溶质的质量分别为10%.求算:
向盛有22.3g碳酸钠和氯化钠固体混合物的烧杯中逐滴加入质量分数为10%的稀盐酸,放出气体的质量与滴入稀盐酸的质量关系如图所示.反应结束后,A点氯化钠溶质的质量分别为10%.求算:(1)原固体混合物中碳酸钠的质量.
(2)A点时溶液中钠元素和氯元素的质量比.
考点:根据化学反应方程式的计算
专题:综合计算(图像型、表格型、情景型计算题)
分析:(1)依据碳酸钠和盐酸的反应,利用反应后溶液的氯化钠的溶质质量分数为10%,可以求出碳酸钠的质量;
(2)利用溶液中钠和氯元素的质量分析解答即可;
(2)利用溶液中钠和氯元素的质量分析解答即可;
解答:解:(1)设参加反应的碳酸钠质量为x.
Na2CO3+2HCl=2NaCl+CO2↑+H2O
106 117 44
x
×100%=10%
x=10.6g
(2)原混合物中氯化钠的质量是22.3g-10.6g=11.7g
则钠元素和氯元素的质量比=(10.6g×
+11.7g×
):(216.1g×10%×
)=9.2g:28.1g=92:281
答:(1)原固体混合物中碳酸钠的质量为10.6g.
(2)A点时溶液中钠元素和氯元素的质量比为92:281.
Na2CO3+2HCl=2NaCl+CO2↑+H2O
106 117 44
x
| 117x |
| 106 |
| 44x |
| 106 |
(22.3g-x)+
| ||
22.3g+216.1g-
|
x=10.6g
(2)原混合物中氯化钠的质量是22.3g-10.6g=11.7g
则钠元素和氯元素的质量比=(10.6g×
| 46 |
| 106 |
| 23 |
| 58.5 |
| 35.5 |
| 36.5 |
答:(1)原固体混合物中碳酸钠的质量为10.6g.
(2)A点时溶液中钠元素和氯元素的质量比为92:281.
点评:本题较好的考查学生利用图象来分析化学反应的能力,学生应明确图象中的关键点及线的变化所表示的含义,将图象和化学反应紧密结合是解题的关键所在.

练习册系列答案
相关题目
下列物质属于纯净物的是( )
| A、干冰 | B、稀盐酸 |
| C、大理石 | D、矿泉水 |
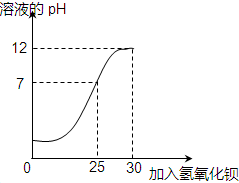 取某稀硫酸溶液22.33g,逐滴加入30g某未知浓度的氢氧化钡溶液,同时用pH计测定并记录反应过程中混合溶液pH变化情况(如图所示).过滤后得滤液50g,请计算该滤液中溶质的质量分数(计算结果精确到0.001%).
取某稀硫酸溶液22.33g,逐滴加入30g某未知浓度的氢氧化钡溶液,同时用pH计测定并记录反应过程中混合溶液pH变化情况(如图所示).过滤后得滤液50g,请计算该滤液中溶质的质量分数(计算结果精确到0.001%).