题目内容
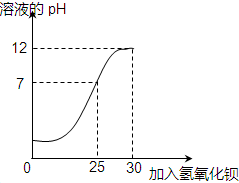 取某稀硫酸溶液22.33g,逐滴加入30g某未知浓度的氢氧化钡溶液,同时用pH计测定并记录反应过程中混合溶液pH变化情况(如图所示).过滤后得滤液50g,请计算该滤液中溶质的质量分数(计算结果精确到0.001%).
取某稀硫酸溶液22.33g,逐滴加入30g某未知浓度的氢氧化钡溶液,同时用pH计测定并记录反应过程中混合溶液pH变化情况(如图所示).过滤后得滤液50g,请计算该滤液中溶质的质量分数(计算结果精确到0.001%).考点:根据化学反应方程式的计算,有关溶质质量分数的简单计算
专题:综合计算(图像型、表格型、情景型计算题)
分析:先根据质量守恒定律求出生成沉淀硫酸钡的质量,再根据化学方程式求出参加反应的氢氧化钡的质量,然后根据溶质质量分数=
×100%即可求解.
| 溶质质量 |
| 溶液质量 |
解答:解:根据质量守恒定律,生成BaSO4质量为22.33g+30g-50g=2.33g
设参加反应的Ba(OH)2的质量为x
Ba(OH)2+H2SO4═BaSO4↓+2H2O
171 233
x 2.33g
=
解得x=1.71g
Ba(OH)2溶液中溶质质量分数=
×100%=6.84%
该滤液中溶质的质量分数=
×100%=0.684%
答:该滤液中溶质的质量分数为0.684%.
设参加反应的Ba(OH)2的质量为x
Ba(OH)2+H2SO4═BaSO4↓+2H2O
171 233
x 2.33g
| 171 |
| x |
| 233 |
| 2.33g |
解得x=1.71g
Ba(OH)2溶液中溶质质量分数=
| 1.71g |
| 25g |
该滤液中溶质的质量分数=
| (30g-25g)×6.84% |
| 50g |
答:该滤液中溶质的质量分数为0.684%.
点评:解答本题关键是抓住反应前后溶液减轻的质量就是生成的沉淀硫酸钡的质量,然后结合图象得出加入的氢氧化钡质量为25g时稀硫酸和氢氧化钡恰好完全反应,只要分析清楚这两点即可较快解答该题.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
某金属加工厂生产过程中的废液含有少量AgNO3、Cu(NO3)2,为回收利用资源和防止污染,该厂向废液中加入一定量的锌粉,反应停之后过滤,向滤出的固体中加入少量的稀盐酸,无气体产生.则下列有关说法中,正确的是( )
| A、滤出的固体中一定含有Ag、Cu,一定不含Zn |
| B、滤出的固体中一定含有Ag,可能含有Zn和Cu |
| C、滤液中一定含有Zn(NO3)2,一定没有AgNO3和Cu(NO3)2 |
| D、滤液中一定含有Zn(NO3)2,可能有AgNO3和Cu(NO3)2 |
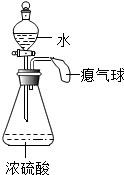 在探究浓硫酸与水混合时,设计如下实验,请回答:
在探究浓硫酸与水混合时,设计如下实验,请回答: 同学们用Na2CO3溶液和浓HCl来研究简易灭火器的反应原理时,对废液的成分进行探究.
同学们用Na2CO3溶液和浓HCl来研究简易灭火器的反应原理时,对废液的成分进行探究.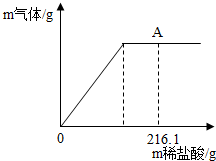 向盛有22.3g碳酸钠和氯化钠固体混合物的烧杯中逐滴加入质量分数为10%的稀盐酸,放出气体的质量与滴入稀盐酸的质量关系如图所示.反应结束后,A点氯化钠溶质的质量分别为10%.求算:
向盛有22.3g碳酸钠和氯化钠固体混合物的烧杯中逐滴加入质量分数为10%的稀盐酸,放出气体的质量与滴入稀盐酸的质量关系如图所示.反应结束后,A点氯化钠溶质的质量分别为10%.求算:
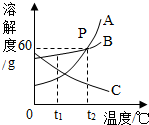 如图为A、B、C三种固体物质的溶解度曲线,根据图示完成下列问题:、
如图为A、B、C三种固体物质的溶解度曲线,根据图示完成下列问题:、