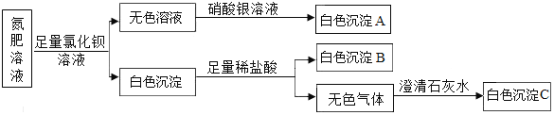
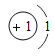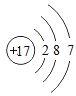题目内容
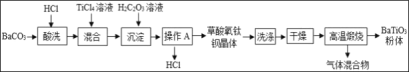
【题目】实验室用辉铜矿(主要成分为Cu2S,含少量Fe2O3、SiO2)制备碱式碳酸铜的主要实验流程如下。已知:二氧化硅不溶于水,也不溶于酸。
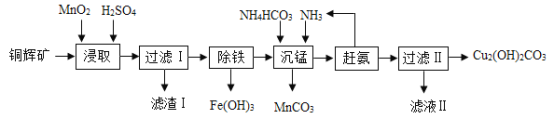
(1)浸取前辉铜矿粉碎成细颗粒,目的是________;
(2)硫酸浸取时,Cu2S被MnO2氧化的化学方程式为2MnO2 + Cu2S + 4H2SO4 = 2MnSO4 + 2CuSO4 +S+4______。滤渣Ⅰ的成分为MnO2、单质S和______(写化学式);
(3)浸取时,Fe2O3溶于硫酸反应的化学方程式为____;研究发现若先除铁再浸取,浸取速率明显变慢,其可能原因是_____;
(4)沉锰时温度不宜过高,除了防止氨水挥发外,还能______;
(5)“赶氨”时,最适宜的操作方法是____,以减小氨气的溶解度;
(6)滤液Ⅱ中溶质主要是(NH4)2SO4,要得到其晶体可采用蒸发浓缩、______、过滤晾干;
(7)经过滤得到的产品碱式碳酸铜需要洗涤、烘干,其中洗涤的方法是向盛有碱式碳酸铜固体的过滤器中加入______,(填字母序号)重复几次即可洗净;
a Na2CO3溶液
b 蒸馏水
c 稀盐酸
(8)检验产品是否洗涤干净的方法:取最后一次洗涤液,__(①滴加稀盐酸、② 滴加Na2SO4 溶液、③ 滴加BaCl2溶液,填写序号),如果无明显的现象,说明已经洗涤干净。
【答案】增大接触面积,加快反应速率 H2O SiO2 Fe2O3+3H2SO4=Fe2(SO4)3+3H2O 铁离子在浸取时起催化作用 防止NH4HCO3分解 加热 降温结晶 b ③
【解析】
(1)浸取前辉铜矿粉碎成细颗粒,目的是增大接触面积,加快反应速率;
(2)由2MnO2+Cu2S+4H2SO4═2MnSO4+2CuSO4+S+4可知,反应前后锰原子都是2个,铜原子都是2个,硫原子都是5个,而反应前氢原子是8个,反应后应该是8个,氧原子反应前是20个,反应后应该是20个,因此4后面应该是由2个氢原子和1个氧原子构成的物质,该物质是水,化学式是H2O;滤渣Ⅰ的成分为MnO2、单质S和没有反应的SiO2;
(3)浸取时,Fe2O3溶于硫酸生成硫酸铁和水,反应的化学方程式为:Fe2O3+3H2SO4=Fe2(SO4)3+3H2O;
研究发现若先除铁再浸取,反应速率明显变慢,其可能原因是铁离子在浸取时起催化作用;(4)沉锰温度不宜过高,除了防止氨水挥发外,还能防止NH4HCO3分解;
(5)因为气体的溶解度随着温度升高而减小,因此“赶氨”时,最适宜的操作方法是加热,以减小氨气的溶解度;
(6)滤液Ⅱ中溶质主要是(NH4)2SO4,得到其晶体可采用蒸发浓缩、降温结晶、过滤晾干;
(7)因为碱式碳酸铜不溶于水,经过滤得到的产品碱式碳酸铜需要洗涤、烘干,其中洗涤的方法是向盛有碱式碳酸铜固体的过滤器中加入蒸馏水;
(8)检验产品是否洗涤干净的方法:取最后一次洗涤液,滴加BaCl2溶液,如果无明显的现象,说明已经洗涤干净。

【题目】如表列出了部分人体中含量较多元素的原子结构示意图.请回答下列问题.
H | O | Na | Mg | Cl | K | Ca |
|
|
|
|
|
|
|
(1)属于第四周期的元素是_____.
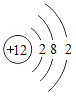
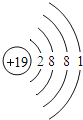
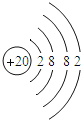
(2)钙元素的核电荷数是_____,若某种该原子的相对原子质量为40,则它的中子数为_____.
(3)一般来说,金属元素的原子最外层电子数目_____(填“<”、“=”或“>”)4个;钠、钾的化学性质有许多相似之处,其原因是_____.
(4)比较下列三种微粒的架构,找出相同点和不同点.
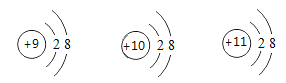
①相同点_____;(写出其中一点即可)
②不同点_____.(写出其中一点即可)