题目内容
【题目】现有氧化镁、氢氧化镁和硫酸镁的混合物10克,加入100克9.8%的稀硫酸恰好完全反应,所得硫酸镁的质量可能是
A.12克B.16克C.17克D.18克
【答案】C
【解析】
氧化镁、氢氧化镁与硫酸反应后都生成硫酸镁,反应前后硫酸根的质量不变,硫酸的质量为:100g×9.8%=9.8g,硫酸根的质量为:9.8g×![]() ×100%=9.6g,设生成硫酸镁的质量为X,则有:
×100%=9.6g,设生成硫酸镁的质量为X,则有:
X×![]() ×100%=9.6g,X=12g;
×100%=9.6g,X=12g;
当与稀硫酸反应的全部是氧化镁时,设氧化镁的质量为m,则有:

![]()
m=4g;
故混合物中硫酸镁的质量为:10g-4g=6g;所得硫酸镁的质量:12g+6g=18g;当与稀硫酸反应的全部是氢氧化镁时,设氢氧化镁的质量为n,则有:
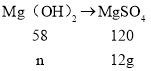
![]()
n=5.8g,
故混合物中硫酸镁的质量为:10g-5.8g=4.2g;所得硫酸镁的质量:4.2g+12g=16.2g;因为混合物10g是氧化镁、氢氧化镁和硫酸镁的混合物,故所得硫酸铜的质量:16.2g~18g之间。
故选C。

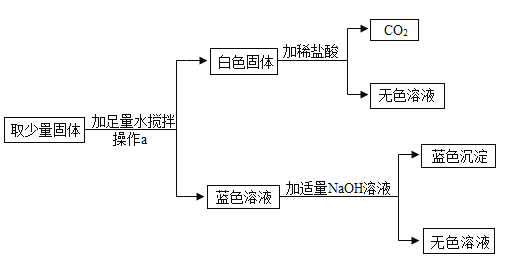
【题目】某同学发现,上个月做实验用的NaOH溶液忘记了盖瓶盖.对于该溶液是否变质,同学们开始实验探究.
(猜想假设)
猜想(1):该溶液没有变质,为NaOH溶液.
猜想(2):该溶液全部变质,为Na2CO3溶液.
猜想(3):该溶液部分变质,为NaOH和Na2CO3的混合溶液.
(查阅资料)Na2CO3溶液呈碱性
(设计方案)请你完善下表几组同学探讨的设计方案
实验操作 | 可能出现的现象与结论 | 同学评价 | |
第1组 |
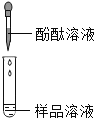
| 若溶液变红,则猜想(2)不成立 | 第2组同学认为:此方案结论不正确,理由是:__. |
第2组 |
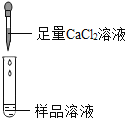
| 若产生白色沉淀,反应方程式是:_____ 则猜想(1)不成立. | 第3组同学认为:此方案还不能确定猜想(2)还是猜想(3)成立. |
第3组 |
| 若滤液不变红,则猜想(2)成立;若滤液变红,则猜想(3)成立. | 第1组同学认为:不需过滤也能达到实验目的,更简单的操作方法是:_____ |
(探究实验)综合各小组的方案后,动手实验.
(结论与反思)(1)NaOH溶液易与空气中_____反应而变质,为防止变质,所以保存时要_____.
(2)第二组实验中,产生沉淀的方程式为:_____.
【题目】碳酸氢铵(NH4HCO3),俗称“碳铵”,是农村常用的氮肥。NH4HCO3可溶于水:受热容易分解,生成三种物质,经检测,这三种物质性质如下:
生成物 | 相关性质 |
生成物(一) | 无色无味的液体,常用作溶剂 |
生成物(二) | 能使澄清石灰水变浑浊的气体。 |
生成物(三) | 有刺激性气味的气体,水溶液呈碱性。 |
(1)请写出碳酸氢铵受热分解的化学方程式:_____。
(2)请预测碳酸氢铵的化学性质,说明预测的依据,并设计实验验证。
限选试剂是:碳酸氢铵粉末、熟石灰、食盐、稀硫酸、紫色石蕊溶液、炭粉、镁条、氧化铜。
预测 | 预测的依据 | 验证预测的实验操作与预期现象 |
①能够与酸类反应 | 碳酸氢铵组成里有碳酸氢根离子 | 取少量碳酸氢铵粉末于试管中,加入足量的_____,如果观察到_____,则预测成立。 |
②能够与_____(填物质类别)反应 | _____ | 取少量碳酸氢铵粉末_____。如果_____,则预测成立。 |