题目内容
【题目】某兴趣小组的同学选择“由 H2O2 生成 O2 的速率与什么因素有关”的课题进行探究实验。以下是他们探究的主要过程。
实验一:探究催化剂对反应速率是否产生影响。
【假设】由 H2O2 生成 O2 的速率与催化剂种类有关。
【方案】常温下,在两瓶同质量、同浓度的 H2O2 溶液中,分别加入相同质量的 MnO2 和氧化铁,测量各生成一瓶(相同体积)O2 所需要的时间。
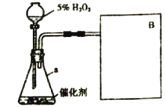
【实验】实验装置如右下图所示。
(1)气体发生装置中仪器 a 的名称:_____________;
(2)此实验中 B 处宜采用的气体收集方法是_____________。
【记录】
实验编号 | 1 | 2 |
|
反应物 | 5%H2O2 | 5%H2O2 | |
催化剂 | 1g 氧化铁 | 1gMnO2 | |
时间 | 166 秒 | 46 秒 |
【结论】该探究过程得出的结论是_______________________________________。
【反思】H2O2 在常温下分解缓慢,加入 MnO2 或氧化铁后反应明显加快。若要证明 MnO2和氧化铁是该反应的催化剂,还需要增加实验来验证它们在化学反应前后的__________是否改变。
实验二:探究反应物的浓度对反应速率是否产生影响。
每次均取 5mL30%的过氧化氢溶液,然后稀释成不同浓度的溶液进行实验,记录数据如下(其他实验条件均相同):
实验次序 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 |
过氧化氢溶液的浓度 | 1% | 3% | 5% | 10% | 15% | 20% | 25% | 30% |
MnO2 的用量(g) | 0.2 | 0.2 | 0.2 | 0.2 | 0.2 | 0.2 | 0.2 | 0.2 |
收集 540mL 气体所用的时间(s) | 660 | 220 | 205 | 80 | 25 | 9 | 4 | 3 |
请分析表中数据回答:过氧化氢的浓度对反应速率产生怎样的影响呢?________________
【答案】 锥形瓶 排水法 在相同条件下,二氧化锰对过氧化氢分解的催化效果比氧化铁好 质量和化学性质 在其他条件一定的情况下,过氧化氢浓度越大,反应速率越快
【解析】(1)气体发生装置中仪器a的名称:锥形瓶;(2) 此实验中B处宜采用的气体收集方法是排水法;【结论】根据表格中的数据可以知道加入了二氧化锰和红砖粉后过氧化氢的分解速率加快,说明在相同条件下,二氧化锰对过氧化氢分解的催化效果比氧化铁好;【反思】根据催化剂的概念可以知道催化剂在反应催化过程中质量和化学性质不变,所以要确定二氧化锰和红砖粉是该反应的催化剂,还需要验证红砖粉和二氧化锰的质量是否发生改变;实验二:分析表中数据可知:在其他条件一定的情况下,过氧化氢浓度越大,反应速率越快。

 亮点激活精编提优100分大试卷系列答案
亮点激活精编提优100分大试卷系列答案