题目内容
【题目】人类的生活和生产都离不开金属.
(1)下列矿石的主要成分属于氧化物的是_______ (填序号)

(2)铁是应用最广泛的金属
①生活中用铁锅做炊具,利用了铁的 ___________性;
②铁制品锈蚀的过程,实际上是铁跟空气中__________和水蒸气等发生了化学反应.为防止铁制栏杆生锈,通常采取的措施是________________ (写一条).
(3)已知金属M和N能够发生如下反应: M+H2SO4═MSO4+H2↑ Fe+MCl2═M+FeCl2
N+FeCl2═Fe+NCl2判断Fe、Cu、M、N的活动性由强到弱的顺序是__________________;以上三个化学反应均属于__________________(填基本反应类型)
(4)在AgNO3、Cu(NO3)2的混合溶液中加入一定量锌粉,充分反应后过滤,得滤渣和滤液.
①若滤液呈无色,则滤渣中一定含有的物质是______________(填化学式);
②若向滤渣中滴加稀盐酸,无明显现象,则滤液中所含溶质的成分可能有_______ 情况,分别是____________________________________________________________(填化学式)。
(5)已知镉(Cd)的金属活动性与铁、锌相近,镉元素在化合物中常显+2价。
a.将镉丝插入下列溶液有明显现象的是__________(填序号)。
①NaCl溶液 ②HCl溶液 ③AgNO3溶液 ④NaOH溶液
b.镍镉电池应用广泛,为了防止污染环境,将废旧镍镉电池中回收镉的一种方法如下:
步骤1:将废旧电池破碎成细颗粒后焙烧,将镉转化为氧化镉(CdO);
步骤2:将含氧化镉的细颗粒和炭粉混合后,隔绝空气加热至1200℃,可得镉蒸气和 一氧化碳。
步骤2中氧化镉变成镉的化学方程式是________________________。
【答案】 AC 导热 氧气 涂漆 N>Fe>M>Cu 置换反应 Cu、Ag 3种 Zn(NO3)2 、Zn(NO3)2和Cu(NO3)2 、Zn(NO3)2和Cu(NO3)2和AgNO3 【答题空10】②③ CdO+C![]() Cd↑+CO↑
Cd↑+CO↑
【解析】(1)赤铁矿石的主要成分Fe2O3、铝土矿的主要成分是Al2O3,由两种元素组成,其中一种元素是氧元素,属于氧化物;(2)①烧菜用的锅必须导热性良好,铁具有良好的导热性,故烧菜用的铁锅主要是利用铁的导热性;②铁生锈实际上是铁跟空气中氧气和水蒸气等发生了化学反应.为防止铁制栏杆生锈,通常采取的措施是涂漆;(3)由金属活动性顺序的具体应用可知:活动性在氢前的金属可以与稀酸反应生成氢气,金属活动性强的金属可以把金属活动性比它弱的金属从其盐溶液中置换出来,所以据M+H2SO4═MSO4+H2↑,Fe+MCl2═M+FeCl2 ,N+FeCl2═Fe+NCl2,可知:M活动性在氢前且比铁弱,N活动性在比铁强,结合金属活动性顺序表可知四种金属的活动性顺序是:N>Fe>M>Cu,从反应类型上看都是一种单质与一种化合物反应生成另一种单质与另一种化合物,故都是置换反应;(4)根据活泼性和一定量锌粉,则先发生Zn+2AgNO3═Zn(NO3)2+2Ag,后发生Zn+Cu(NO3)2═Zn(NO3)2+Cu,①若滤液呈无色,说明Cu(NO3)2完全反应或锌过量,则滤渣中一定含有Ag、Cu、,可能有锌;②若向滤渣中滴加稀盐酸,无明显现象,说明没有锌,则反应的情况是:只有少量AgNO3反应了、AgNO3完全反应了、少量Cu(NO3)2反应了、三者恰好完全反应,所以滤液中所含溶质的成分:Zn(NO3)2 、Zn(NO3)2和Cu(NO3)2 、Zn(NO3)2和Cu(NO3)2和AgNO3;
(5) a.镉(Cd)的金属活动性与铁、锌相近,所以①镉不能与NaCl反应;②镉可以置换HCl中的氢元素;③镉可以置换AgNO3溶液中的银;④金属镉不能与NaOH溶液反应;b.氧化镉的细颗粒和炭粉混合后,隔绝空气加热至1200℃,可得镉蒸气和一氧化碳,方程式为:CdO+C![]() Cd↑+CO↑。
Cd↑+CO↑。

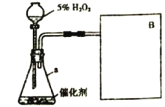
【题目】某兴趣小组的同学选择“由 H2O2 生成 O2 的速率与什么因素有关”的课题进行探究实验。以下是他们探究的主要过程。
实验一:探究催化剂对反应速率是否产生影响。
【假设】由 H2O2 生成 O2 的速率与催化剂种类有关。
【方案】常温下,在两瓶同质量、同浓度的 H2O2 溶液中,分别加入相同质量的 MnO2 和氧化铁,测量各生成一瓶(相同体积)O2 所需要的时间。
【实验】实验装置如右下图所示。
(1)气体发生装置中仪器 a 的名称:_____________;
(2)此实验中 B 处宜采用的气体收集方法是_____________。
【记录】
实验编号 | 1 | 2 |
|
反应物 | 5%H2O2 | 5%H2O2 | |
催化剂 | 1g 氧化铁 | 1gMnO2 | |
时间 | 166 秒 | 46 秒 |
【结论】该探究过程得出的结论是_______________________________________。
【反思】H2O2 在常温下分解缓慢,加入 MnO2 或氧化铁后反应明显加快。若要证明 MnO2和氧化铁是该反应的催化剂,还需要增加实验来验证它们在化学反应前后的__________是否改变。
实验二:探究反应物的浓度对反应速率是否产生影响。
每次均取 5mL30%的过氧化氢溶液,然后稀释成不同浓度的溶液进行实验,记录数据如下(其他实验条件均相同):
实验次序 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 |
过氧化氢溶液的浓度 | 1% | 3% | 5% | 10% | 15% | 20% | 25% | 30% |
MnO2 的用量(g) | 0.2 | 0.2 | 0.2 | 0.2 | 0.2 | 0.2 | 0.2 | 0.2 |
收集 540mL 气体所用的时间(s) | 660 | 220 | 205 | 80 | 25 | 9 | 4 | 3 |
请分析表中数据回答:过氧化氢的浓度对反应速率产生怎样的影响呢?________________
【题目】黄铜(由锌和铜形成的合金)有较强的耐磨性能,在生活中有广泛的用途。晓军同学为了测定黄铜屑样品组成,分四次取样品与稀硫酸反应,其实验数据记录如下表:
实验 | 1 | 2 | 3 | 4 |
样品质量/g | 25.0 | 25.0 | 25.0 | 30.0 |
稀硫酸质量/g | 80 | 100 | 120 | 100 |
产生气体质量/g | 0.4 | 0.5 | 0.5 | 0.5 |

回答:(1)第__________ 次实验中黄铜与稀硫酸恰好完全反应。
(2)25g黄铜样品中锌的质量__________。
(3)所用稀硫酸中溶质质量分数为_____________。(写计算过程)
(4)现要配制200g这种溶质质量分数为的稀硫酸,需要溶质质量分数为98%的浓硫酸的质量为___________g,需加水的体积为___________mL(水的密度为1g/cm3)。
【题目】小明、小强和小峰在学习了“质量守恒定律”后来到化学实验室亲自进行了实验探究,如图是他们分别设计的实验,请你与他们一起进行探究,并回答问题.

实验1:称量镁条,点燃,待反应结束后,再称量.
实验2:将盛有稀盐酸的小试管放入盛有锌粒的烧杯中称量,然后使稀盐酸与锌粒接触,充分反应后再称量.
实验3:将盛有氢氧化钠溶液的小试管放入盛有硫酸铜溶液的锥形瓶中称量,然后使氢氧化钠溶液与硫酸铜溶液混合,充分反应后再称量.
数据见下表:(锌与盐酸反应:Zn+2HCl=ZnCl2+H2↑;氢氧化钠溶液与硫酸铜溶液反应:CuSO4+2NaOH═Cu(OH)2↓+Na2SO4)
编号 | 实验1 | 实验2 | 实验3 |
反应前称量质量 | 9.6g | 212.6g | 118.4g |
反应后称量质量 | 16.0g | 212.4g | 118.4g |
(1)写出实验1反应的化学方程式_____.
(2)上述三个反应_____(填“符合”或“不符合”)质量守恒定律,实验_____正确反映了反应物与生成物的质量关系.
(3)由上述实验我们得到启示,探究_____的反应验证质量守恒定律,实验必须在密闭的装置中进行.
(4)由质量守恒定律可知,化学反应前后,一定不变的是_____(填序号).
①物质种类②元素种类③原子种类④分子种类⑤分子数目⑥原子数目.