题目内容
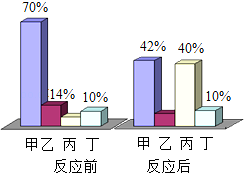
【题目】在密闭容器中有甲、乙、丙、丁四种物质,在一定条件下反应,测得反应前后各物质的质量分数如图所示.下列说法正确的是
A.丙可能是单质
B.若消耗3g的乙,则生成17g的丙
C.丁一定是该反应的催化剂
D.甲、乙的质量之和一定等于生成丙的质量
【答案】B
【解析】
试题分析:根据前后质量的变化判断是反应物还是生成物,甲反应前是70%,反应后为42%,质量减少了28%,是反应物,乙反应前是14%,反应后为1-42%-40%-10%=8%,质量减少了6%,是反应物,丙反应前是1-70%-14%-10%=6%,反应后为30%,质量增加了34%,是生成物,丁的质量不变,故反应可表示为:甲+乙→丙,A、丙是化合反应的生成物,不可能是单质,错误,B、根据质量变化,可判断乙、丙的质量关系为3:17,故若消耗3 g的乙,则生成17 g的丙,正确,C、物质Z在反应前后的质量不变,但并不知道是否改变了化学反应速率,故可能是该反应的催化剂,错误,D、根据质量守恒定律,参加反应的甲、乙的质量之和一定等于生成丙的质量,错误,故选B

 七星图书口算速算天天练系列答案
七星图书口算速算天天练系列答案【题目】某兴趣小组的同学选择“由 H2O2 生成 O2 的速率与什么因素有关”的课题进行探究实验。以下是他们探究的主要过程。
实验一:探究催化剂对反应速率是否产生影响。
【假设】由 H2O2 生成 O2 的速率与催化剂种类有关。
【方案】常温下,在两瓶同质量、同浓度的 H2O2 溶液中,分别加入相同质量的 MnO2 和氧化铁,测量各生成一瓶(相同体积)O2 所需要的时间。
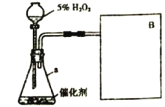
【实验】实验装置如右下图所示。
(1)气体发生装置中仪器 a 的名称:_____________;
(2)此实验中 B 处宜采用的气体收集方法是_____________。
【记录】
实验编号 | 1 | 2 |
|
反应物 | 5%H2O2 | 5%H2O2 | |
催化剂 | 1g 氧化铁 | 1gMnO2 | |
时间 | 166 秒 | 46 秒 |
【结论】该探究过程得出的结论是_______________________________________。
【反思】H2O2 在常温下分解缓慢,加入 MnO2 或氧化铁后反应明显加快。若要证明 MnO2和氧化铁是该反应的催化剂,还需要增加实验来验证它们在化学反应前后的__________是否改变。
实验二:探究反应物的浓度对反应速率是否产生影响。
每次均取 5mL30%的过氧化氢溶液,然后稀释成不同浓度的溶液进行实验,记录数据如下(其他实验条件均相同):
实验次序 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 |
过氧化氢溶液的浓度 | 1% | 3% | 5% | 10% | 15% | 20% | 25% | 30% |
MnO2 的用量(g) | 0.2 | 0.2 | 0.2 | 0.2 | 0.2 | 0.2 | 0.2 | 0.2 |
收集 540mL 气体所用的时间(s) | 660 | 220 | 205 | 80 | 25 | 9 | 4 | 3 |
请分析表中数据回答:过氧化氢的浓度对反应速率产生怎样的影响呢?________________
【题目】小明、小强和小峰在学习了“质量守恒定律”后来到化学实验室亲自进行了实验探究,如图是他们分别设计的实验,请你与他们一起进行探究,并回答问题.

实验1:称量镁条,点燃,待反应结束后,再称量.
实验2:将盛有稀盐酸的小试管放入盛有锌粒的烧杯中称量,然后使稀盐酸与锌粒接触,充分反应后再称量.
实验3:将盛有氢氧化钠溶液的小试管放入盛有硫酸铜溶液的锥形瓶中称量,然后使氢氧化钠溶液与硫酸铜溶液混合,充分反应后再称量.
数据见下表:(锌与盐酸反应:Zn+2HCl=ZnCl2+H2↑;氢氧化钠溶液与硫酸铜溶液反应:CuSO4+2NaOH═Cu(OH)2↓+Na2SO4)
编号 | 实验1 | 实验2 | 实验3 |
反应前称量质量 | 9.6g | 212.6g | 118.4g |
反应后称量质量 | 16.0g | 212.4g | 118.4g |
(1)写出实验1反应的化学方程式_____.
(2)上述三个反应_____(填“符合”或“不符合”)质量守恒定律,实验_____正确反映了反应物与生成物的质量关系.
(3)由上述实验我们得到启示,探究_____的反应验证质量守恒定律,实验必须在密闭的装置中进行.
(4)由质量守恒定律可知,化学反应前后,一定不变的是_____(填序号).
①物质种类②元素种类③原子种类④分子种类⑤分子数目⑥原子数目.