题目内容
【题目】现有下图所示的实验装置,请回答问题:

(1)仪器a的名称是__________________仪器b的名称是_________________。
(2)实验室用过氧化氢溶液和MnO2粉末制取氧气,发生和收集装置应选用___________。(填字母序号)
(3)在加入药品前,检查氧气制取装置气密性的方法是___________。
(4)检验一瓶气体是氧气的方法是_________________________。
(5)实验室中用块状固体硫化亚铁(FeS)与稀硫酸反应制取硫化氢(H2S)气体。通常情况下,硫化氢气体的密度比空气大,能溶于水形成氢硫酸。请根据以上信息判断:实验室制取硫化氢气体应选择的发生装置是(填字母序号)_________,收集装置是(填字母序号)__________。
【答案】 分液漏斗 锥形瓶 BC(有错误或遗漏不得分) 关闭分液漏斗的活塞,将导气管浸入水中,双手紧握锥形瓶,若导管口有气泡冒出,则装置不漏气 将一根带火星的木条伸入集气瓶中,若木条复燃,证明是氧气 B C
【解析】(1)图中a仪器的名称是分液漏斗,b仪器的名称是锥形瓶;(2))实验室用过氧化氢溶液和MnO2粉末制取氧气的反应条件是不加热,故选固液不加热型装置,收集时选向上排空气法,故选BC;(3)检查氧气制取装置气密性的方法是连接好仪器,将导管的另一端放入水中,用手握住锥形瓶,如有气泡冒出,则气密性良好;(4)检验氧气的方法是将带火星的木条放入集气瓶中,如复燃,则是氧气;(5)用块状固体硫化亚铁(FeS)与稀硫酸反应制取硫化氢(H2S)的反应条件是不加热,选择固液不加热型装置B,由于硫化氢是易溶于水,密度比空气的密度大的气体,选择向上排空气法收集,故选择的收集装置为C。

【题目】某兴趣小组的同学选择“由 H2O2 生成 O2 的速率与什么因素有关”的课题进行探究实验。以下是他们探究的主要过程。
实验一:探究催化剂对反应速率是否产生影响。
【假设】由 H2O2 生成 O2 的速率与催化剂种类有关。
【方案】常温下,在两瓶同质量、同浓度的 H2O2 溶液中,分别加入相同质量的 MnO2 和氧化铁,测量各生成一瓶(相同体积)O2 所需要的时间。
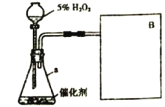
【实验】实验装置如右下图所示。
(1)气体发生装置中仪器 a 的名称:_____________;
(2)此实验中 B 处宜采用的气体收集方法是_____________。
【记录】
实验编号 | 1 | 2 |
|
反应物 | 5%H2O2 | 5%H2O2 | |
催化剂 | 1g 氧化铁 | 1gMnO2 | |
时间 | 166 秒 | 46 秒 |
【结论】该探究过程得出的结论是_______________________________________。
【反思】H2O2 在常温下分解缓慢,加入 MnO2 或氧化铁后反应明显加快。若要证明 MnO2和氧化铁是该反应的催化剂,还需要增加实验来验证它们在化学反应前后的__________是否改变。
实验二:探究反应物的浓度对反应速率是否产生影响。
每次均取 5mL30%的过氧化氢溶液,然后稀释成不同浓度的溶液进行实验,记录数据如下(其他实验条件均相同):
实验次序 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 |
过氧化氢溶液的浓度 | 1% | 3% | 5% | 10% | 15% | 20% | 25% | 30% |
MnO2 的用量(g) | 0.2 | 0.2 | 0.2 | 0.2 | 0.2 | 0.2 | 0.2 | 0.2 |
收集 540mL 气体所用的时间(s) | 660 | 220 | 205 | 80 | 25 | 9 | 4 | 3 |
请分析表中数据回答:过氧化氢的浓度对反应速率产生怎样的影响呢?________________