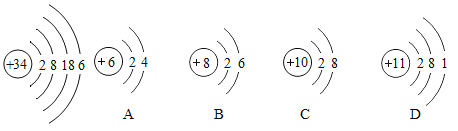
题目内容
【题目】自来水厂净水过程示意图如图。请回答下列问题:
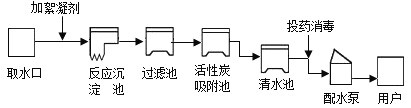
(1)除去水中固态杂质的设备是______(填序号)
A过滤池 B吸附池 C清水池
(2)吸附池中利用了活性炭所具有的很强的_____性,该过程属于____(填“物理”或“化学”)变化。
(3)生活中可以用________区别硬水和软水,常采用_________的方法降低水的硬度。
(4)通常向清水池投放高铁酸钠(化学式为Na2FeO4)杀菌消毒,高铁酸钠中铁元素的化合价为______;高铁酸钠(Na2FeO4)被广泛应用于自来水净化消毒,其原理为:4Na2FeO4+10____=4Fe(OH)3(胶体)+3____+8NaOH(请将化学方程式补充完整)。
(5)我国有关部门规定,经上述流程净化后进入用户的饮用水含铁<0.3mgL-1,含铜<1.0mgL-1,….其中的“铁、铜”指的是______(填序号)
A原子 B分子 C元素
【答案】A 吸附 物理 肥皂水 煮沸 +6 H2O O2 C
【解析】
(1)过滤是把不溶于液体的固体与液体分离的一种方法,图中除去水中固态杂质的设备是过滤池。故选A;
(2)吸附池中利用了活性炭所具有的很强的吸附性,吸附水中色素和异味,该过程没有新物质生成,属于物理变化;
(3)水样加热肥皂水搅拌,泡沫多的软水,泡沫少的是硬水,生活中可以用肥皂水区别硬水和软水;天然水煮沸,水中的可溶性钙、镁化合物,转化沉淀,水的硬度降低。常采用_煮沸的方法降低水的硬度;
(4)在高铁酸钠(Na2FeO4)中,钠元素显+1价,氧元素显-2价,设铁元素的化合价是x,根据在化合物中正负化合价代数和为零,可得:(+1)×2+x+(-2)×4=0,则x=+6价。根据质量守恒定律和化学方程式可知,参加反应的物质有水,生成物中有氧气,化学方程式为:4Na2FeO4+10 H2O =4Fe(OH)3(胶体)+3O2+8NaOH;
(5)物质是由元素组成,我国有关部门规定,经上述流程净化后进入用户的饮用水含铁<0.3mgL-1,含铜<1.0mgL-1,….其中的“铁、铜”指的是元素,故选C。

 浙江之星课时优化作业系列答案
浙江之星课时优化作业系列答案 激活思维优加课堂系列答案
激活思维优加课堂系列答案