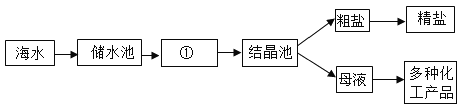
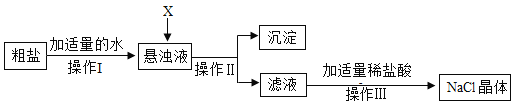
题目内容
【题目】以下为制备纳米CaCO3的一种流程:
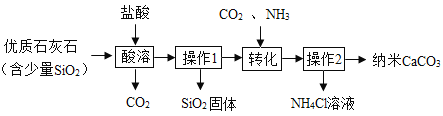
(1)实验室中进行操作1、2时,所用玻璃仪器有______、玻璃棒和烧杯。
(2)该流程中可以循环使用的物质是______。
(3)操作2中产生的氯化铵在农业上可用作______。
(4)操作2所得固体用蒸馏水洗涤。检验固体已洗净的方法是______。
(5)实验时将250克含碳酸钙为80%的矿石用盐酸溶解,至少需要7.3%的稀盐酸______克.(写出计算过程)
【答案】漏斗 二氧化碳 氮肥 取最后一次洗涤后的滤液,滴加硝酸银溶液,无现象 2000g
【解析】
(1)实验室中进行操作1、2都是将固体与液体分离,属于过滤,所用玻璃仪器有漏斗(用于过滤)、玻璃棒(用于引流)和烧杯(用于承接滤液)。
(2)优质石灰石加入稀盐酸产生的二氧化碳正好能与氨气混合后与氯化钙溶液反应产生碳酸钙和氯化铵,该流程中可以循环使用的物质是:二氧化碳;
(3)操作2中产生的氯化铵中含有氮元素,在农业上可用作:氮肥;
(4)操作2所得碳酸钙固体用蒸馏水洗涤。检验固体已洗净的方法是确定滤液中是否含有氯化铵,需要取最后一次洗涤后的滤液,滴加硝酸银溶液,因为硝酸银能与氯化铵反应产生氯化银白色沉淀,若无现象;说明洗涤干净,若产生氯化银白色沉淀,则说明未洗涤干净;
(5)解:设需要7.3%的稀盐酸溶质质量为x。

![]() x=146g
x=146g
至少需要7.3%的稀盐酸=![]()

【题目】武汉将成为我国首个新型氢能城市。某化学兴趣小组在老师的帮助下围绕氢气的燃烧实验开展如下探究:
(1)点燃氢气前,一定先要________。点燃纯净的氢气可以看到淡蓝色火焰现象,该反应的化学方程式为________,该反应的基本类型为______反应。
(2)研究氢气燃烧实验,需要用试管收集不同体积比的氢气与空气的混合物,若用试管(假设试管容积为10mL)收集氢气与空气体积比为4:1的混合气体,其操作方法为________。
(3)用不同体积比的混合气体做氢气的燃烧实验,结果如表:
序号 | 1 | 2 | 3 | 4 | 5 | 6 | 7 |
氢气与空气体积比 | 9:1 | 8:2 | 7:3 | 5:5 | 3:7 | 1:9 | 0.5:9.5 |
点燃现象 | 安静 燃烧 | 安静 燃烧 | 弱的 爆鸣声 | 强的 爆鸣声 | 强的 爆鸣声 | 弱的 爆鸣声 | 不燃烧 不爆鸣 |
请分析上表信息,你对燃烧或燃烧条件的新认识是可燃物能否燃烧除具备燃烧条件,还要考虑到________。