题目内容
小强去商店买回一包纯碱,包装说明如右图.为测定该纯碱中碳酸钠含量是否符合标签要求,他称取了纯碱样品11g,全部溶解在50g水中,当加入稀盐酸64.4g时,恰好完全反应,所得溶液的质量为121g.试求:
(1)反应放出的CO2的质量为 g。
(2)纯碱样品中碳酸钠的质量。
(3)根据这一次检测,计算并判断样品中碳酸钠的含量是否符合标签要求。
(1)4.4g (2)10.6g (3)不符合标签要求。
解析试题分析:(1)根据质量守恒定律可以求算出生成的二氧化碳的质量;
(2)根据二氧化碳的质量结合化学方程式可以求算出碳酸钠的质量,根据质量分数的计算公式计算出碳酸钠的质量;
(3)根据(2)碳酸钠的质量即可求出碳酸钠的质量分数后与包装说明相比较即可完成解答。
解:(1)根据质量守恒定律可以知道生成二氧化碳的质量为:11g+50g+64.4g﹣121g=4.4g;
(2)设纯碱样品中碳酸钠的质量为x
Na2CO3+2HCl=2NaCl+H2O+CO2↑
106 44
x 4.4g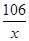 =
=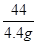
解得:x=10.6g
(3)纯碱样品中碳酸钠的质量分数为: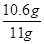 ×100%=96.4%
×100%=96.4%
因为96.4%<98%,所以该纯碱样品中碳酸钠的质量分数不符合标签要求。
答:(2)纯碱样品中碳酸钠的质量为10.6g;
(3)该纯碱样品中碳酸钠的质量分数不符合标签要求。
考点:考查根据化学反应方程式的计算

 教学练新同步练习系列答案
教学练新同步练习系列答案某化学实验小组要检测黄铜(铜、锌合金)中金属铜的纯度,同学们取20g黄铜样品,向其中分三次共加入15g盐酸溶液,充分反应后测得实验结果如下:
| 实验次数 | 1 | 2 | 3 |
| 盐酸质量 | 5g | 5g | 5g |
| 氢气质量 | 0.04g | m | 0.02g |
请计算:(1)第二次实验产生氢气的质量m= g。
(2)黄铜(铜、锌合金)中金属铜的纯度。
我国青海湖采集的天然碱样品可表示为aNa2CO3·bNaHCO3·cH2O(a、b、c为最简整数比)。小红同学为测定其组成,称取该天然碱样品16.6g进行如下实验: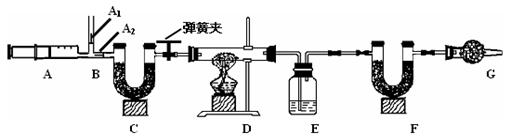
已知:1.碳酸钠比较稳定,加热时不分解 ;2. 2NaHCO3 Na2CO3 +CO2 ↑ +H2O
Na2CO3 +CO2 ↑ +H2O
3.图中B处为两个单向阀:推注射器时A1关闭,A2处打开;拉注射器时,A1打开进空气,A2关闭。
实验步骤
实验时,组装好装置,实验前应先 ,然后,实验步骤是:
① 反复推拉注射器 ② 称量E、F的质量 ③ 关闭弹簧夹,加热D处试管直到反
应不再进行 ④ 打开弹簧夹,再次反复缓缓推拉注射器 ⑤ 再次称量E、F的质量。
(二)问题探究:
(2) E中的药品为 ,E的作用是 。C、F、G中装有碱石灰(生石灰与烧碱的固体混合物),则C的作用是 , F的作用是 。写出 F装置中所发生反应的一个化学方程式 。
(3)实验步骤②与③能否颠倒 (填“能”或“不能”)。若不进行步骤④的操作,则所测得的碳酸氢钠质量 (填“偏大”、“偏小”、“无影响”), 该操作中推注射器时缓缓的目的是 ;若没有G装置,则碳酸氢钠的质量 (填“偏大”、“偏小”、“无影响”)。
(4)下表是实验记录数据:
| 反应前 | 反应后 |
| E的质量为100.0g | E的质量为102.25g |
| F的质量为50.0g | F的质量为51.1g |
② 碳酸氢钠的质量为 g
③ 该天然碱的化学式中a:b:c= 。
(5分)哈南新城在地铁建设中需要大量的钢铁,现有赤铁矿样品(所含杂质不溶于水也不与酸反应),实验小组同学为测定其纯度,
进行了三次实验,实验数据如下表所示。请回答下列问题:
| | 第1次 | 第2次 | 第3次 |
| 样品质量(g) | 25 | 30 | 25 |
| 盐酸质量(g) | 200 | 100 | 100 |
| 所得溶液质量(g) | 216 | 116 | 116 |
(2)列出第2次参加反应的盐酸中溶质质量(X)的比例式 ;
(3)向恰好完全反应后的溶液中加入46.5g水,则最终所得的溶液中溶质的质量分数为 ;
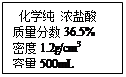
(4)若用上述标签所示的浓盐酸配制三次实验中所需的盐酸,需量取浓盐酸的体积
为 mL;
(5)用500t该矿石可制得含杂质的铁的质量为 。

