题目内容
某化学实验小组要检测黄铜(铜、锌合金)中金属铜的纯度,同学们取20g黄铜样品,向其中分三次共加入15g盐酸溶液,充分反应后测得实验结果如下:
| 实验次数 | 1 | 2 | 3 |
| 盐酸质量 | 5g | 5g | 5g |
| 氢气质量 | 0.04g | m | 0.02g |
请计算:(1)第二次实验产生氢气的质量m= g。
(2)黄铜(铜、锌合金)中金属铜的纯度。
解:(1)0.04g; (2)83.75%
解析试题分析:(1)根据第一、三组中加入盐酸的量和生成的气体质量进行分析;
(2)根据生成氢气的量和锌与盐酸反应的方程式中的等量关系进行分析。
解:(1)第一次加5克盐酸生成0.04克氢气,第三次加5克的盐酸还生成了0.02克的氢气,说明第二次反应中金属是过量的,也生成0.04克氢气,故答案为:0.04g;
(2)解:设共生成(0.04g+0.04g+0.02g=0.1g)氢气,需金属锌的质量为x
Zn+2HCl=ZnCl2+H2↑
65 2
x 0.1g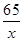 =
=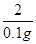
X=3.25g
合金中铜的质量分数即纯度: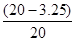 ×100%=83.75%
×100%=83.75%
答:黄铜(铜、锌合金)中金属铜的纯度为:83.75%
考点:考查根据化学反应方程式的计算;质量守恒定律及其应用

练习册系列答案
相关题目
1.6克由碳、氢两种元素组成的某化合物在氧气中完全燃烧生成3.6克水,则同时生成二氧化碳的质量为( )
| A.4.4克 | B.8.8克 | C.2.2克 | D.4.0克 |
某工业盐酸中因含有少量FeCl3(不含其它杂质)而显黄色,测知该盐酸中H+和Cl﹣的个数比为88:97,则其中Fe3+和Cl﹣的个数比为( )
| A.1:97 | B.1:3 | C.3:1 | D.3:97 |
已知20℃时硝酸钾的溶解度为31.6g。在该温度下将20g硝酸钾放入50g水中,充分搅拌,则所得溶液中溶质的质量分数约为
| A.24.0% | B.28.6% | C.31.6% | D.40.0% |
请根据化学方程式计算:完全分解340g溶质质量分数为10%的过氧化氢溶液中的过氧化氢(H2O2),最多可生成氧气质量是
| A.16g | B.160g | C.32g | D.1.6g |

