��Ŀ����
ʵ������һƿ�����Һ����ʦ��С��ͬѧ��Ʒ����ⶨ�÷�Һ�����������������С��ͬѧ��ȡһ����С�ձ�����������Ϊ18.2g��Ȼ�������е������������Һ�������������Ϊ33.2g��֮��һö����Ϊ10.8g������������ɰֽɰȥ���⣩�����С�ձ��з�Ӧ�����������治�������ݲ������ٴγ�����������Ϊ43.9g����ش��������⣺
��1����Ӧ�в���������������� ��
��2������÷�Һ�����������������д��������̣�����������һλС������
��3���������������δ�������ԣ�2����������Ӱ���� ��ѡ�ƫ����ƫС��������Ӱ�족����ԭ���� ��
0.1g����������Ӧ�����������Ϊx
Fe+H2SO4�TFeSO4+H2��
98 2
X 0.1g 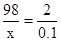 x=4.9g��
x=4.9g��
�÷�Һ���������������Ϊ��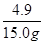 ��100%=32.7%�� �𣺷�Һ�����������������32.7%��
��100%=32.7%�� �𣺷�Һ�����������������32.7%��
ƫС������Ҳ������һ�������ᡣ
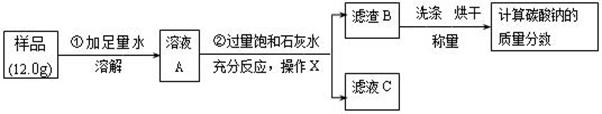
�����������������ϡ���ᷴӦ�������������������������ϡ���ᷴӦ������������ˮ��������������������������������������е����ʵ������������������������������������Ϊ��33.2g+10.8g��43.9g=0.1g����������Ӧ�����������Ϊx����ϻ�ѧ����ʽ�������������� С�ձ���ϡ�����Һ������Ϊ��33.2g��18.2g=15.0g���������������������㹫ʽ������ã��������������δ����������������һ�������ᣬ�����������������������ƫС���Ӷ�ʹ��������������������ƫС��
���㣺���ݻ�ѧ��Ӧ����ʽ�ļ��㣻�й��������������ļ���

 ���ɶ��ȫ���ƿؾ�ϵ�д�
���ɶ��ȫ���ƿؾ�ϵ�д�(7��)ˮ������֮Դ����������ϧˮ��Դ��ÿ����������Ρ�
��1����Ȼ���е�ˮ���Ǵ�ˮ�������ó����� ������������ȷ������Ծ���ˮ��
��2��ˮ���������Ƹ�����Һ��������������ˮ����Һ�¶��������ߵ��� ��
| A���������� | B������� | C������� | D��Ũ���� |
��4������ˮƿ�þú�ƿ���ڱڳ�����һ��ˮ�����Լ����ȥƿ����5g CaCO3���������躬5%�����ʳ�������Ƕ��٣�
�ۻ�ѧ����ʽΪ��CaCO3 + 2CH3COOH= (CH3COO)2 Ca + H2O + CO2����
(����������)
��ˮ����Ҫ�ɷ���CaCO3��Mg(OH)2��һЩ������������ʣ�����ȥ5g��ˮ���������ʳ����������������ݱȽϣ��� (����ӡ����ٻ�ȷ����)
��5�֣�ijУ����С���ͬѧ�ڲⶨ��MgCl2��NaCl��ɵĹ�����������ʱ������������ʵ�顣ȡ20�˹������200����Һ��ƽ���ֳ��ķݣ�Ȼ��ֱ����һ������������NaOH��Һ������ʵ�����ݼ��±���
| | ʵ��һ | ʵ��� | ʵ���� | ʵ���� |
| ����������Һ������/g | 50 | 50 | 50 | 50 |
| ����NaOH��Һ������/g | 10 | 20 | 30 | 40 |
| ���ɳ���������/g | 1 | m | 2.9 | 2.9 |
��1��m= ��
��2��20gԭ����������Һ������NaOH��Һ��Ӧ������ɳ��������� g��
��3����ʵ�����У���ȫ��Ӧ��������Һ���Ȼ��Ƶ����������Ƕ��٣����������һλС����д��������̣� ��
ͬѧ�Ǵ�ɽ�ϲɼ���һ��ʯ��ʯ������ȡ80�˸���Ʒ��������ʵ��(�������������չ����в������仯)����÷�Ӧ����������(m)�뷴Ӧʱ��(t)�Ĺ�ϵ���±���
| ��Ӧʱ��t�Ms | t0 | t1 | t2 | t3 | t4 | t5 | t6 |
| ��Ӧ����������m�Mg | 80 | 75 | 70 | 66 | 62 | 58 | 58 |
��ش��������⣺
��1����ʯ��ʯ��ȫ��Ӧ������CO2������Ϊ g��
��2�����ʯ��ʯ��CaCO3������������д��������̡�



 CO + H2��
CO + H2��