题目内容
(3分)欲测定Cu﹣Zn合金及Cu﹣Ag合金中铜的质量分数,实验室只提供一瓶未标明质量分数的稀硫酸和必要的仪器。
(1)你认为能测出铜的质量分数的是_________ 合金。
(2)取该合金的粉末32.5g与足量该硫酸充分反应,经测定产生了0.4g气体。
请你计算该合金中铜的质量分数。
(1)Cu﹣Zn(2)合金中铜的质量分数为60%
解析试题分析:(1)在铜银合金中,两种金属的活动性均在氢的后面。所以都不能和酸发生反应。因此无法测出其中的成分。在铜锌合金中,铜不与酸反应,锌能与酸反应生成氢气。所以可通过测量生成氢气的质量(或固体与酸充分反应后的减少的质量),得知金属锌的质量。进一步求出铜的质量分数。 即现有条件下能测出铜锌合金中铜的质量分数。
(2)已知量:氢气的质量为0.4g;未知量:铜在合金中的质量分数。
解题思路:可根据锌与硫酸反应的化学方程式,利用锌和氢气在反应中的质量关系求解出合金中含锌的质量。进一步求出铜的质量及其中合金中的质量分数。具体解题过程如下:
【解】设合金中Zn的质量为x。
Zn+H2SO4 ZnSO4+H2↑
65 2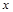 4g
4g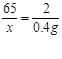
x =" 13" g
合金中铜的质量=" 32.5g" – 13g = 19.5g
合金中铜的质量分数为: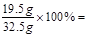 60%
60%
答:合金中铜的质量分数为60%。(其它合理解法均可)
考点:根据化学方程式的计算

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
(7分)为测定某纯碱样品(含氢氧化钠杂质)中碳酸钠的含量,进行如下实验:取65g纯碱样品平均分为5份,分别加入相同质量分数的稀盐酸溶液,获得如下实验数据:
| 实验 | 1 | 2 | 3 | 4 | 5 |
| 样品质量/g | 13 | 13 | 13 | 13 | 13 |
| 加入盐酸质量/g | 15 | 30 | 80 | 130 | 150 |
| 反应后物质质量/g | 28 | 43 | 90.8 | 138.6 | 158.6 |
(2)纯碱样品中Na2CO3的质量分数是多少?(写出计算过程,结果保留小数点后一位)
(3)13g样品与盐酸恰好完全反应后生成物溶液中溶质的质量分数是 。(只写结果,保留小数点后一位)
(4)若向13g样品中持续不断的加入稀盐酸,请你画出加入稀盐酸与生成气体的质量关系图。(在答题卡的坐标中作图)