题目内容
(3分)实验室有一瓶硫酸废液,老师请小红同学设计方案测定该废液中硫酸的质量分数。小红同学先取一洁净小烧杯,称其质量为18.2g,然后往其中倒入适量的硫酸废液后称量,总质量为33.2g,之后,将一枚质量为10.8g的铁钉(已用砂纸打磨去掉铁锈)放入该小烧杯中反应,当反应后的溶液呈中性时再次称量,总质量为43.9 g。请回答下列问题:
反应中产生的气体的质量是。
计算该废液中硫酸的质量分数(写出计算过程,计算结果保留一位小数)。
如果铁钉的铁锈未除净,对计算结果的影响是 (选填“偏大”、“偏小”、“无影响”) 。
(1)0.1g(2)32.7%(3)偏小
解析试题分析:(1)可根据质量守恒定律计算出生成气体的质量。33.2g+10.8 g -43.9 g =0.1g
(2)已知量:氢气的质量0.1g 未知量:硫酸的质量分数。
解题思路:可通过化学方程式中氢气与纯硫酸的质量关系求解出纯硫酸的质量。进一步求出硫酸的质量分数。具体过程如下:解:设参加反应硫酸的质量为x
Fe+H2SO4="=" FeSO4+ H2↑
98 2
X 0.1g
98 :X = 2:0.1g
X =4.9g
硫酸的质量分数为(4.9/33.2-18.2)×100%=32.7%……… (1分)
(3)如果铁钉的铁锈未除净,则其中一部分硫酸会与铁锈反应。这部分硫酸不在计算的范围内。所以会使计算结果偏小。
考点:综合计算

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
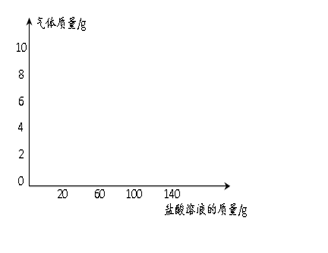
小学生10分钟应用题系列答案(7分)为测定某纯碱样品(含氢氧化钠杂质)中碳酸钠的含量,进行如下实验:取65g纯碱样品平均分为5份,分别加入相同质量分数的稀盐酸溶液,获得如下实验数据:
| 实验 | 1 | 2 | 3 | 4 | 5 |
| 样品质量/g | 13 | 13 | 13 | 13 | 13 |
| 加入盐酸质量/g | 15 | 30 | 80 | 130 | 150 |
| 反应后物质质量/g | 28 | 43 | 90.8 | 138.6 | 158.6 |
(2)纯碱样品中Na2CO3的质量分数是多少?(写出计算过程,结果保留小数点后一位)
(3)13g样品与盐酸恰好完全反应后生成物溶液中溶质的质量分数是 。(只写结果,保留小数点后一位)
(4)若向13g样品中持续不断的加入稀盐酸,请你画出加入稀盐酸与生成气体的质量关系图。(在答题卡的坐标中作图)
张南同学为测定某赤铁矿样品中氧化铁的含量,取10g此样品,分五次向其中加入稀硫酸使之充分反应(假设样品中杂质不与稀硫酸反应,也不溶于水)。每次加入的稀硫酸质量及测定剩余固体的质量,记录数据如下表:
| | 第一次 | 第二次 | 第三次 | 第四次 | 第五次 |
| 加入稀硫酸的质量/g | l0 | l0 | l0 | l0 | l0 |
| 剩余固体质量/g | 8.4 | 6.8 | 5.2 | 3.6 | 3.6 |
请认真分析表中的数据,回答下列问题:
(1)表示样品与稀梳酸恰好完全反应的是上表中第 次操作;
(2)写出样品中氧化铁与稀硫酸反应的化学方程式 ;
(3)列出充分反应后求解生成水质量(X)的比例式为 ;
(4)样品中氧化铁的含量为 ;
(5)假设第四次实验结束后,向所得混合物中入ag水,得到溶质质量分数为10%的硫酸铁溶液,则a的数值为 ;
(6)若实验用98%的浓硫酸配制上述所用稀硫酸(50g),需要浓硫酸的质量为 。