题目内容
【题目】生石灰是白色块状固体,生石灰被大量用做建筑材料,也是许多工业的重要原料,在日常生活的应用非常广泛,人类很早就会通过烧制石灰石来获得生石灰,请回答关于生石灰的相关问题:
(1)工业用烧制石灰石的方法获得生石灰,化学反应方程式是_______
(2)日常生活中常用的一种干燥剂,其成分是生石灰,生石灰做干燥剂不可以干燥的气体有__________。
A H2 B O2 C CO2 D HCl E NH3
(3)养鱼的池塘里也会定期洒少量的生石灰粉末,用以减少鱼类疾病的发生,撒入生石灰,池塘水的pH________7。(填“>”“<”或“=”)
【答案】CaCO3![]() CaO+CO2↑ CD >
CaO+CO2↑ CD >
【解析】
(1)煅烧石灰石生成氧化钙和二氧化碳,反应的化学方程式是为:CaCO3![]() CaO+CO2↑.
CaO+CO2↑.
(2)CaO是碱性氧化物,会与酸性气体反应,CO2和HCl 都能与氧化钙反应,不能干燥;
(3)氧化钙可以和水反应生成氢氧化钙,溶液呈碱性,撒入生石灰后的池塘水的pH大于7.
答案:
(1)CaCO3![]() CaO+CO2↑.
CaO+CO2↑.
(2)CD;
(3)>.

 暑假衔接教材期末暑假预习武汉出版社系列答案
暑假衔接教材期末暑假预习武汉出版社系列答案 假期作业暑假成长乐园新疆青少年出版社系列答案
假期作业暑假成长乐园新疆青少年出版社系列答案【题目】氢氧化钠如果保存不当容易吸收空气中的二氧化碳而变质[NaOH(Na2CO3)]。某化学课外活动小组的同学,为了测定实验室因部分变质的氢氧化钠中碳酸钠的质量分数,设计了如图所示的装置(图中铁架台已经略去),实验在27℃、101kPa下进行。
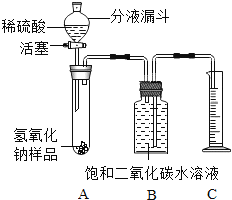
实验步骤如下:
①按图连接好装置;
②用天平准确称取氢氧化钠样品mg,放入A中试管内,向B中集气瓶内倒入饱和二氧化碳水溶液至瓶颈处;
③向分液漏斗中倒入稀硫酸,打开活塞,让稀硫酸滴入试管中至过量,关闭活塞。反应结束后,量筒中收集到饱和二氧化碳水溶液VmL;
④计算氢氧化钠样品中碳酸钠的质量分数。
请回答下列问题:
(1)氢氧化钠发生变质的化学方程式:________。
(2)在实验步骤①和②之间,还缺少一实验步骤,该实验步骤是_______。
(3)B中集气瓶盛装的饱和二氧化碳水溶液不能用水代替,其原因是_______。
(4)叙述检验氢氧化钠部分变质的方法:
实验步骤 | 实验现象 | 实验结论 |
①取样,溶于水,滴加过量的_______ | 产生白色沉淀 | 氢氧化钠部分变质 |
②静置,向上层清液中滴加________ | _____ |
(5)取10g变质的氢氧化钠于烧杯中,其中碳元素的质量分数为6%,向烧杯中加入100g一定质量分数的稀盐酸(足量),则反应结束后烧杯内物质的总质量是____g