题目内容
【题目】氢氧化钠如果保存不当容易吸收空气中的二氧化碳而变质[NaOH(Na2CO3)]。某化学课外活动小组的同学,为了测定实验室因部分变质的氢氧化钠中碳酸钠的质量分数,设计了如图所示的装置(图中铁架台已经略去),实验在27℃、101kPa下进行。
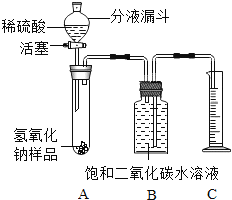
实验步骤如下:
①按图连接好装置;
②用天平准确称取氢氧化钠样品mg,放入A中试管内,向B中集气瓶内倒入饱和二氧化碳水溶液至瓶颈处;
③向分液漏斗中倒入稀硫酸,打开活塞,让稀硫酸滴入试管中至过量,关闭活塞。反应结束后,量筒中收集到饱和二氧化碳水溶液VmL;
④计算氢氧化钠样品中碳酸钠的质量分数。
请回答下列问题:
(1)氢氧化钠发生变质的化学方程式:________。
(2)在实验步骤①和②之间,还缺少一实验步骤,该实验步骤是_______。
(3)B中集气瓶盛装的饱和二氧化碳水溶液不能用水代替,其原因是_______。
(4)叙述检验氢氧化钠部分变质的方法:
实验步骤 | 实验现象 | 实验结论 |
①取样,溶于水,滴加过量的_______ | 产生白色沉淀 | 氢氧化钠部分变质 |
②静置,向上层清液中滴加________ | _____ |
(5)取10g变质的氢氧化钠于烧杯中,其中碳元素的质量分数为6%,向烧杯中加入100g一定质量分数的稀盐酸(足量),则反应结束后烧杯内物质的总质量是____g
【答案】![]() 检查装置气密性 避免二氧化碳溶解在水中而损耗,造成测定结果偏低 氯化钙溶液 酚酞溶液 溶液变红 107.8
检查装置气密性 避免二氧化碳溶解在水中而损耗,造成测定结果偏低 氯化钙溶液 酚酞溶液 溶液变红 107.8
【解析】
(1)氢氧化钠在空气中易吸收空气中的水分而潮解,然后会与空气中的二氧化碳反应而变质,所以氢氧化钠若变质,则会生成碳酸钠,化学方程式为:2NaOH+CO2═Na2CO3+H2O.那么当滴入稀硫酸时会产生二氧化碳气体,所以A中会冒出气泡;
(2)该实验过程中有气体参与,所以实验前必须检查装置的气密性;
(3)本题的实验目的是通过测二氧化碳的体积来计算药品中碳酸钠的含量,所以必须保证二氧化碳的准确性,因为二氧化碳可以溶于水,所以用饱和的二氧化碳水溶液,可以避免二氧化碳的减少;
(4)检验氢氧化钠部分变质,既要鉴定含有碳酸钠又要鉴定含有氢氧化钠,鉴定碳酸钠就是鉴定碳酸根离子,可通过与氯化钙反应生成碳酸钙来鉴定,鉴定氢氧化钠就是鉴定氢氧根离子,可通过其能使无色酚酞试液变红来进行鉴定,实验过程如下。
实验步骤 | 实验现象 | 实验结论 |
1.取样,溶于水,滴加过量的氯化钙溶液 | 产生白色沉淀 | 氢氧化钠部分变质 |
2.静置,向上层清液中滴加酚酞溶液 | 变红 |
(5)根据质量守恒,可知原物质中的碳元素的质量就是生成二氧化碳中碳元素的质量,10g变质的氢氧化钠中碳元素的质量为10g×6%=0.6g;所以设可得二氧化碳的质量为x
x×![]() ×100%=0.6g,解得x=2.2g
×100%=0.6g,解得x=2.2g
所以反应结束后烧杯内物质的总质量为10g+100g-2.2g=107.8g
答:反应结束后烧杯内物质的总质量为107.8g。
故答案为:
(1)2NaOH+CO2═Na2CO3+H2O;
(2)检查装置气密性;
(3)避免二氧化碳溶解在水中而损耗,造成测定结果偏低;
(4)氯化钙溶液;酚酞溶液;溶液变红;
(5)107.8。

 智能训练练测考系列答案
智能训练练测考系列答案 计算高手系列答案
计算高手系列答案