��Ŀ����
����Ŀ��MnSO4H2O�ڹ�ҵ��ũҵ�ȷ����й㷺��Ӧ�á�
��һ���Ʊ�����ҵ���û�����β���е�Ũ��SO2�����̿���Ҫ�ɷ�MnO2�����ʽ���Ԫ��Mg��Al��Fe�ȣ��Ʊ�MnSO4H2O�������£�
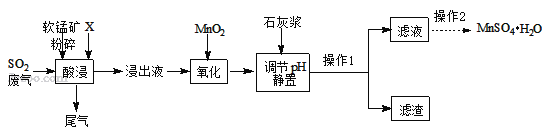
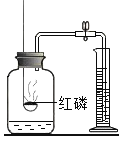
��֪������Һ����������Ҫ��H+��Mn2+��Mg2+��Fe2+��Al3+�ȣ����������з�������Ҫ��Ӧ��ѧ����ʽΪ��MnO2+SO2=MnSO4��
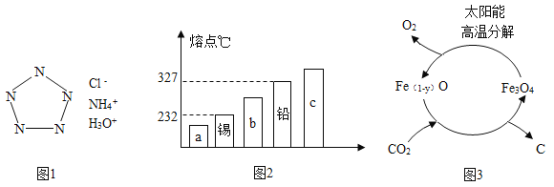
��1�������н����̿�����Ŀ����____��
��2������X���ѡ��_____��
a.���� b.���� c.����
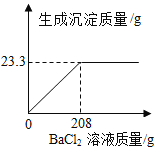
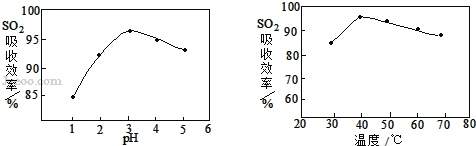
��3�����ʱSO2������Ч����pH���¶ȵĹ�ϵ����ͼ��ʾ��Ϊ���SO2������Ч�ʣ����ʱpH������____���ң��¶ȿ�����_________�����������ˡ�
��4���������������������Ŀ���ǽ�Fe2+ ����ΪFe3+�������Ʒ�Ӧ�Ļ�ѧ����ʽMnO2+2FeSO4+_______ = MnSO4 + Fe2(SO4)3 + 2H2O����
��5������ʯ�ҽ�����pH���ɽ�������Ľ���Һ�����������γ����������ȥ��
��֪����һ���й������������pH��Ӧ��
�������� | Fe(OH)3 | Al(OH)3 | Mn(OH)2 | Mg(OH)2 |
��ʼ����pH | 1.8 | 4.1 | 8.3 | 9.4 |
��ȫ����pH | 3.2 | 5.0 | 9.8 | 12.4 |
������Fe3+����KSCN��Һ������Ѫ��ɫ���ʯ�ҽ�ʱӦ������Һ��pH��ΧΪ_________���ⶨ��Һ��pH���ѡ____��a.pH��ֽ b.pH�ƣ�������Fe3+�Ƿ��������ѷ�����________��
��6������1�������˺�ϴ�ӣ������õ��IJ����������ձ�����������_____��ϴ�ӵ�Ŀ����________
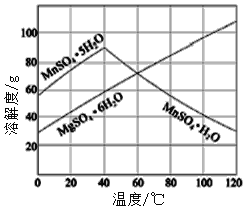
��7����֪�����̡�����þ�ᾧˮ������ܽ��������ͼ�������2����������Ũ����___________�����ˡ�ϴ�ӡ����
������Ӧ�ã�
��8����MnSO4�ɲⶨˮ���ܽ����������ǣ�ȡ100mL ˮ����Ѹ�ټ�������MnSO4��Һ������NaOH��KI��Һ�������������ӡ���ʹ֮��ַ�Ӧ�������ӣ�Ѹ�ټ���������ϡ���ᣬ��ʱ��I2���ɣ�����0.79gL��1Na2S2O3��Һ��I2��Ӧ��������Na2S2O3��Һ 12.0mLʱ��Ӧ��ȫ���йػ�ѧ��Ӧ����ʽ�£�
��2MnSO4+O2+4NaOH=2MnO(OH)2+2Na2SO4��
��MnO(OH)2 + 2KI + 2H2SO4 = MnSO4 + K2SO4 + I2 + 3H2O��
��I2 + 2Na2S2O3 = Na2S4O6 + 2NaI��
����ˮ�����ܽ�����Ũ�ȣ���mgL-1Ϊ��λ����д���������________��
���𰸡�����Ӧ��ĽӴ�������ӿ췴Ӧ���� b 3 40 2H2SO4 С��3.2 b ȡ�ϲ���ҹ����������KSCN��Һ������Һ��δ����Ѫ��ɫ��˵��Fe3+�Ѿ����� ©�� ϴȥ��������������� ���½ᾧ 4.8mg/L
��������
(1)���ڷ�Ӧ��֮��Ӵ�Խ��֣���ӦԽ�죬ת��Ҳ��Խ���ף����������н����̿�����Ŀ��������Ӧ��ĽӴ�������ӿ췴Ӧ���ʣ�����д������Ӧ��ĽӴ�������ӿ췴Ӧ���ʣ�
(2)��������ж����������ᷴӦ����������Ŀ�������������̣����ԣ�����X���ѡ�����ᣬ����д��b��
(3)��ͼ��֪��pH=3���¶�Ϊ40��ʱ����ͼ��������궼Ϊ���ֵ��Ϊ��߶�������������ʣ����ʱpH������3���ң��¶ȿ�����40��������ã�����д��3��40��
(4)�����С������������Ŀ���ǽ�Fe2+ ����ΪFe3+�����ݻ�ѧ��Ӧǰ��Ԫ�������ԭ�Ӹ��������֪����Ҫ�����Ӧ��������������ӣ�����д��2H2SO4��
(5)�ɱ���֪��Fe(OH)3��ʼ������pHΪ1.8ʱ����ȫ������pHΪ3.2ʱ��Ϊ��ʹFe3+���������������������ֳ�����ȫ��pHӦ�����ڲ���С��3.2������д�� С��3.2��
�����Ǿ�ȷ���������ԣ�ѡ�þ�ȷ�ȸ��ߵ�pH�ƣ�����д��b��
���ݸ����ġ�Fe3+����KSCN��Һ������Ѫ��ɫ����֪������Fe3+�Ƿ��������ѷ�����ȡ�ϲ���ҹ����������KSCN��Һ������Һ��δ����Ѫ��ɫ��˵��Fe3+�Ѿ�����������д��ȡ�ϲ���ҹ����������KSCN��Һ������Һ��δ����Ѫ��ɫ��˵��Fe3+�Ѿ�������
(6)����1�������˺�ϴ�ӣ������õ��IJ����������ձ�����������©��������д��©����
ϴ�ӵ�Ŀ���ǽ����������������ϴȥ���õ�����������̲������д��ϴȥ��������������̣�
(7)��ͼ��֪�������̽ᾧˮ������ܽ�������ߣ����¶�����40��ʱ���ֿ�ʼ���ͣ��ɴ˵ó����ڵõ������̽ᾧˮ����ʱ��Ҫ���������ᾧ�ͽ��½ᾧ���õķ���������д�����½ᾧ��
(8)���ĵ�Na2S2O3��Һ����������Ϊ��0.79gL��1�� =0.00948g��
=0.00948g��
�⣺��100mL ˮ��������������Ϊx
�ɢ�2MnSO4+O2+4NaOH=2MnO(OH)2+2Na2SO4�ɵã�O2��2MnO(OH)2�Ĺ�ϵʽ��
�ɢ�MnO(OH)2 + 2KI + 2H2SO4 = MnSO4 + K2SO4 + I2 + 3H2O�ɵã�MnO(OH)2��I2�Ĺ�ϵʽ��
�ɢ�I2 + 2Na2S2O3 = Na2S4O6 + 2NaI�ɵã�I2��2Na2S2O3�Ĺ�ϵʽ��
���������ù�ϵʽ�ۺϵģ�O2��2MnO(OH)2��2I2��4Na2S2O3

ˮ�����ܽ�����Ũ��Ϊ�� =0.48mg/mL������д��0.48mg/mL��
=0.48mg/mL�������0.48mg/mL��

 ��У����ϵ�д�
��У����ϵ�д�����Ŀ�����л�ѧ֪ʶ���������������������ȫ��ȷ��һ���ǣ�
A.�����ʾ | B.��ѧ�����ܳ����� |
�� �� | ��������--�������ԭ������ �ں�°�--�����������η� |
C.ʵ��������Ⱥ�˳�� | D.��ѧԪ�������彡�� |
�ٵ�ȼ��ȼ�����塪�����鴿���ȼ ��CO��ԭCuO�����ȼ��Ⱥ�ͨ��CO | ��ȱ��Ԫ��--������ƶѪ ��ȱ��Ԫ��--�������״���״� |
A.AB.BC.CD.D
����Ŀ��ij��ѧ����Χ��������кͷ�Ӧ������ѧ���ֳ�����С�鿪չ̽��������������һ���������ʵ��̽����
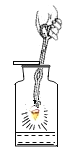
����ʾʵ�飩��һ����ϡ������뵽ʢ����������Һ��С�ձ��С��÷�Ӧ�Ļ�ѧ����ʽ��_____________��
���������ϣ�CaC12 ��Һ������
��������⣩ʵ����δ�۲쵽����������ͬѧ���������ʣ���Ӧ����Һ�����ʵijɷ���ʲô��
����������裩������ʣ�����ͬѧ�������£�
����I��ֻ��CaC12
����II����__________
����III����CaC12��Ca(OH)2
����IV����CaCl2��HCl��Ca(OH)2
����ͬѧ�����ϲ���������ɣ���Ϊ����IV����������������_________��
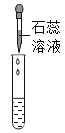
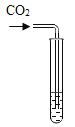
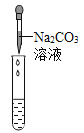
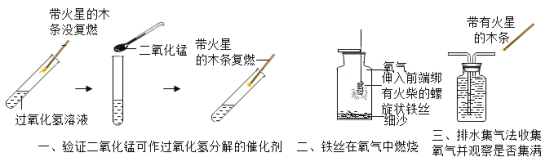
��ʵ��̽����Ϊ����֤������룬��С���������������������̽����
ʵ�鷽�� | �μ���ɫʯ����Һ | ͨ��CO2 | �μ�Na2CO3��Һ |
ʵ����� |
|
|
|
ʵ������ | ____________ | __________ | ������ɫ���� |
ʵ����� | ��Һ�к���Ca(OH)2 | ��Һ�к���Ca(OH)2 | ��Һ�к���Ca(OH)2 |
���ó����ۣ�ͨ��̽����ȫ��ͬѧһ��ȷ������III����ȷ�ġ�
�����۷�˼�� ��1������ͬѧ��Ϊ�μ�Na2CO3��Һ������ɫ������������֤����Һ��һ������Ca(OH)2�������������˵��ԭ��____________��
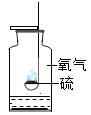
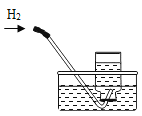
����Ŀ������ʵ��ָ�������е�ˮ�������û������ˮ����Ҫ���õ��ǣ� ��
A | B | C | D | |
ʵ �� װ �� |
����������ȼ�� |
�ⶨ�������������� |
��˿��������ȼ�� |
��ˮ���ռ����� ������������ˮ�� |
���� | ����ƿ�е�ˮ:���շų������� | ��Ͳ�е�ˮ:ͨ��ˮ����ı仯�ó�O2��� | ����ƿ�е�ˮ����ȴ�����������ֹ����ƿը�� | ����ƿ�е�ˮ��ˮ�Ƚ�����ƿ�ڵĿ����ž�������ڹ۲�������ʱ�ռ��� |
A.AB.BC.CD.D