题目内容
【题目】某化学课堂围绕“酸碱中和反应”,将学生分成若干小组开展探究活动。请你和他们一起完成以下实验探究。
(演示实验)将一定量稀盐酸加入到盛氢氧化钙溶液的小烧杯中。该反应的化学方程式是_____________。
(查阅资料)CaC12 滚液显中性
(提出问题)实验中未观察到明显现象,部分同学产生了疑问:反应后溶液中溶质的成分是什么?
(猜想与假设)针对疑问,甲组同学猜想如下:
猜想I:只有CaC12
猜想II:有__________
猜想III:有CaC12和Ca(OH)2
猜想IV:有CaCl2、HCl和Ca(OH)2
乙组同学对以上猜想提出质疑,认为猜想IV不合理,其理由是_________。
(实验探究)为了验证其余猜想,各小组进行了下列三个方案的探究。
实验方案 | 滴加紫色石蕊溶液 | 通入CO2 | 滴加Na2CO3溶液 |
实验操作 |
|
|
|
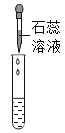
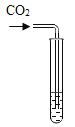
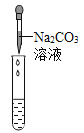
实验现象 | ____________ | __________ | 产生白色沉淀 |
实验结论 | 溶液中含有Ca(OH)2 | 溶液中含有Ca(OH)2 | 溶液中含有Ca(OH)2 |
(得出结论)通过探究,全班同学一致确定猜想III是正确的。
(评价反思) (1)丙组同学认为滴加Na2CO3溶液产生白色沉淀,并不能证明溶液中一定含有Ca(OH)2,请你帮助他们说明原因____________。
【答案】2HCl+Ca(OH)2=CaCl2+2H2O CaCl2和HCl HCl和Ca(OH)2不能共存(可以发生反应) 溶液变为蓝色 溶液变浑浊(有白色沉淀产生) 氯化钙与碳酸钠也能反应产生白色沉淀
【解析】
演示实验:将一定量稀盐酸加入到盛氢氧化钙溶液的小烧杯中。该反应的化学方程式是:2HCl+Ca(OH)2=CaCl2+2H2O;
猜想II:有CaCl2和HCl;
乙组同学对以上猜想提出质疑,认为猜想IV不合理,其理由是:HCl和Ca(OH)2不能共存(可以发生反应);
实验探究:
实验一:滤液中加入石蕊溶液,溶液变为蓝色,则溶液显碱性,溶液中含有Ca(OH)2;
实验二:滤液中通入二氧化碳气体,溶液变浑浊,因为CO2+Ca(OH)2=CaCO3↓+H2O;
评价反思 :(1)丙组同学认为滴加Na2CO3溶液产生白色沉淀,并不能证明溶液中一定含有Ca(OH)2,请你帮助他们说明原因:氯化钙与碳酸钠也能反应产生白色沉淀,CaCl2+Na2CO3=2NaCl+CaCO3↓。

 初中学业考试导与练系列答案
初中学业考试导与练系列答案【题目】(1)实验室部分装置如图所示,回答下列问题:
①仪器X的名称是___。
②实验室用装置B制O2的化学方程式为___。
③若实验室欲用上述装置制取并收集一瓶干燥的二氧化碳气体,需在B、C之间连接上 装置___。(填序号,下同)
④实验室常用加热无水醋酸钠和碱石灰固体混合物的方法制取甲烷(CH4)气体,应选用的发 生装置是___。
(2)某兴趣小组同学在整理实验室时发现一瓶标签破损的溶液M(标签如图),同学们对该 溶液进行了一系列的研究。
探究一:M溶液中的溶质是什么?
(提出猜想)该小组同学认为M溶液的溶质有两种可能:
①是___,②是CaCl2。
(收集资料)CaCl2溶液呈中性。
(设计实验)同学们设计了如下方案并进行实验:
实验操作 | 实验现象 | 实验结论 |
取少量M溶液于试管中,向其中滴加酚酞溶液。 | 溶液变_____。 | 猜想①正确。 |
探究二:同学们取少量M溶液与碳酸钠溶液进行反应,发现有白色沉淀产生,过 滤后得到澄清滤液。写出碳酸钠与M反应的化学方程式:___。 探究三:过滤后澄清滤液中有哪些溶质?
(提出猜想)猜想一:NaOH和Na2CO3;猜想二:___;猜想三:NaOH
(实验验证)设计实验方案确定滤液中溶质的组成。
实验操作 | 实验现象 | 实验结论 |
分别取少量滤液于A、B两支试管中,A中加入BaCl2溶液,B中加入___溶液。 | 若A中产生白色沉淀,B中没有沉淀 | “猜想一”成立 |
______ | “猜想二”成立 | |
_____ | “猜想三”成立 |
【题目】MnSO4H2O在工业、农业等方面有广泛的应用。
(一)制备:工业上用化工厂尾气中低浓度SO2与软锰矿(主要成分MnO2,杂质金属元素Mg、Al、Fe等)制备MnSO4H2O过程如下:
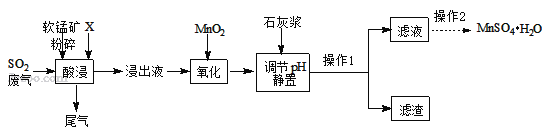
已知:浸出液中阳离子主要有H+、Mn2+、Mg2+、Fe2+、Al3+等;浸出过程中发生的主要反应化学方程式为:MnO2+SO2=MnSO4。
(1)生产中将软锰矿粉碎的目的是____。
(2)物质X最好选用_____。
a.盐酸 b.硫酸 c.硝酸
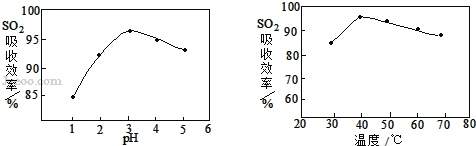
(3)酸浸时SO2的吸收效率与pH、温度的关系如下图所示,为提高SO2的吸收效率,酸浸时pH控制在____左右,温度控制在_________℃左右最适宜。
(4)流程中“氧化”步骤的目的是将Fe2+ 氧化为Fe3+,请完善反应的化学方程式MnO2+2FeSO4+_______ = MnSO4 + Fe2(SO4)3 + 2H2O 。
(5)加入石灰浆调节pH,可将氧化后的浸出液中杂质离子形成氢氧化物除去。
已知:(一)有关氢氧化物沉淀pH对应表
氢氧化物 | Fe(OH)3 | Al(OH)3 | Mn(OH)2 | Mg(OH)2 |
开始沉淀pH | 1.8 | 4.1 | 8.3 | 9.4 |
完全沉淀pH | 3.2 | 5.0 | 9.8 | 12.4 |
(二)Fe3+能与KSCN溶液作用显血红色则加石灰浆时应控制溶液的pH范围为_________。测定溶液的pH最好选____(a.pH试纸 b.pH计),检验Fe3+是否除尽的最佳方法是________。
(6)操作1包括过滤和洗涤,过滤用到的玻璃仪器有烧杯、玻璃棒和_____,洗涤的目的是________
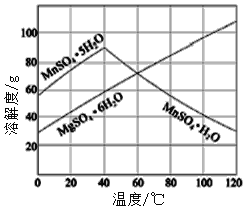
(7)已知硫酸锰、硫酸镁结晶水合物的溶解度曲线如图,则操作2包括:蒸发浓缩,___________,过滤、洗涤、干燥。
(二)应用:
(8)用MnSO4可测定水中溶解氧。方法是:取100mL 水样,迅速加入足量MnSO4溶液及含有NaOH的KI溶液,立即塞上塞子、振荡,使之充分反应;打开塞子,迅速加入适量的稀硫酸,此时有I2生成;再用0.79gL﹣1Na2S2O3溶液和I2反应,当消耗Na2S2O3溶液 12.0mL时反应完全。有关化学反应方程式下:
①2MnSO4+O2+4NaOH=2MnO(OH)2+2Na2SO4;
②MnO(OH)2 + 2KI + 2H2SO4 = MnSO4 + K2SO4 + I2 + 3H2O;
③I2 + 2Na2S2O3 = Na2S4O6 + 2NaI。
计算水样中溶解氧的浓度(以mgL-1为单位),写出计算过程________。