��Ŀ����
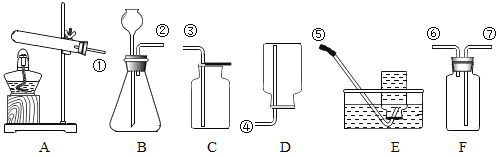
����Ŀ����ͼ��ʾ��ʵ������ȡ����IJ���װ��ͼ����ش��������
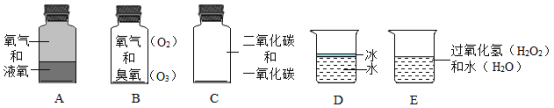
(1)ͼ�б��Ϊ�ٵ�����������Ϊ_______
(2)�����������Ѳ����ܴ�������ʱ���ȰѲ����ܿ�____��Ȼ��������ϵ�С����������ת����������롣
(3)ijͬѧ��ȡ����ʱ������װ��ѡA���䷴Ӧԭ��(�û�ѧ����ʽ)____
(4)��Ȳ��һ����ɫ��ζ���ܶȱȿ���С��������ˮ�Ŀ�ȼ�����壬����Ӧ��ʵ���ҳ��õ�ʯ(����)��ˮ��Ӧ��ȡ��Ȳ�����ڷ�Ӧ̫���ң����ñ����Ȼ�����Һ����ˮ�����й���ʵ������ȡ��Ȳ��˵����ȷ������_________��
A ����װ�����ѡװ��A
B ��ѡ��װ��B������Ϊ�÷�Ӧ����Ҫ����
C ����װ��C���Կ��Ʒ�Ӧ�ķ�����ֹͣ
D ��װ��D�ռ���Ȳʱ������Ӧ����b�˽���
E ���Ҫ�ռ��ϴ�������Ȳ���������ˮ���ռ�
F ����ȼ�ŵ�ľ���쵽����ƿ�ڼ�����Ȳ�����Ƿ��ռ���
(5)����ʵ�鲻�ܴﵽԤ��Ŀ�ĵ���____(����һ��������)
���𰸡��ƾ��� ��ˮ��ʪ 2H2O2![]() 2H2O+O2�� DE ��
2H2O+O2�� DE ��
��������
��1��ͼ�б��Ϊ�ٵ�����������Ϊ���ƾ��ơ�
��2�������������Ѳ����ܴ�������ʱ���ȰѲ����ܿ���ˮ��ʪ��������װ��������Ȼ��������ϵ�С����������ת����������롣
��3��ijͬѧ��ȡ����ʱ��ѡ���Һ����װ��ѡA���䷴Ӧԭ����2H2O2![]() 2H2O+O2����
2H2O+O2����
��4��A������װ�����ѡװ��C���з�Һ©������ѡ�����
B����ѡ��װ��B������Ϊ�÷�Ӧ����Ҫ���ȣ�ͬʱ���Կ��Ʒ�Ӧ���ʣ���ѡ�����
C������װ��C���Կ��Ʒ�Ӧ���ʣ���ѡ�����
D����װ��D�ռ���Ȳʱ����Ȳ�����ܶ�С�ڿ���ѡ�̹ܽ������ܳ���������Ӧ����b�˽��룻��ѡ����ȷ��
E����Ȳ���岻����ˮ��Ҫ�ռ��ϴ�������Ȳ���������ˮ���ռ�����ѡ����ȷ��
F�����ܿ���ȼ�ŵ�ľ���쵽����ƿ�ڼ�����Ȳ�����Ƿ��ռ�����������Σ�գ�
��ѡ��DE��
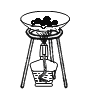
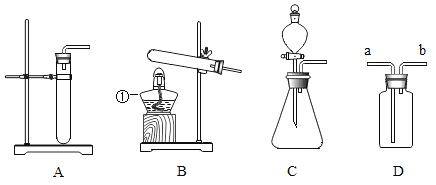
��5��ͼһ������������̵��Թ��ܲ����������������Ǵ����ǵ�ľ����ȼ��������֤���������д����ã�
ͼ������˿�������״��Ϊ��������˿��������Ӧ�ĽӴ�����������������ʹ��˿ȼ�գ�
ͼ������ˮ���ռ�������ʱ��Ӧ�ô�����ƿ��ߵIJ������ܷ��ô����ǵ�ľ����֤�����Ƿ��ռ������ʲ��ܵ���ʵ��Ŀ�ģ�
��ѡ������

 һ��һ��һ��ͨϵ�д�
һ��һ��һ��ͨϵ�д� �㽭֮��ѧҵˮƽ����ϵ�д�
�㽭֮��ѧҵˮƽ����ϵ�д�����Ŀ��MnSO4H2O�ڹ�ҵ��ũҵ�ȷ����й㷺��Ӧ�á�
��һ���Ʊ�����ҵ���û�����β���е�Ũ��SO2�����̿���Ҫ�ɷ�MnO2�����ʽ���Ԫ��Mg��Al��Fe�ȣ��Ʊ�MnSO4H2O�������£�
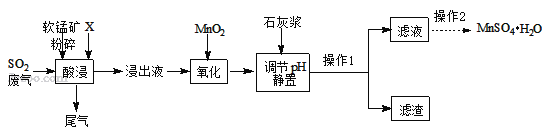
��֪������Һ����������Ҫ��H+��Mn2+��Mg2+��Fe2+��Al3+�ȣ����������з�������Ҫ��Ӧ��ѧ����ʽΪ��MnO2+SO2=MnSO4��
��1�������н����̿�����Ŀ����____��
��2������X���ѡ��_____��
a.���� b.���� c.����
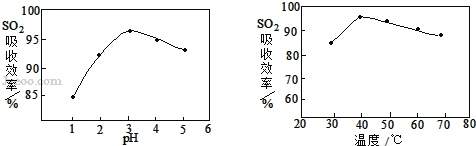
��3�����ʱSO2������Ч����pH���¶ȵĹ�ϵ����ͼ��ʾ��Ϊ���SO2������Ч�ʣ����ʱpH������____���ң��¶ȿ�����_________�����������ˡ�
��4���������������������Ŀ���ǽ�Fe2+ ����ΪFe3+�������Ʒ�Ӧ�Ļ�ѧ����ʽMnO2+2FeSO4+_______ = MnSO4 + Fe2(SO4)3 + 2H2O����
��5������ʯ�ҽ�����pH���ɽ�������Ľ���Һ�����������γ����������ȥ��
��֪����һ���й������������pH��Ӧ��
�������� | Fe(OH)3 | Al(OH)3 | Mn(OH)2 | Mg(OH)2 |
��ʼ����pH | 1.8 | 4.1 | 8.3 | 9.4 |
��ȫ����pH | 3.2 | 5.0 | 9.8 | 12.4 |
������Fe3+����KSCN��Һ������Ѫ��ɫ���ʯ�ҽ�ʱӦ������Һ��pH��ΧΪ_________���ⶨ��Һ��pH���ѡ____��a.pH��ֽ b.pH�ƣ�������Fe3+�Ƿ��������ѷ�����________��
��6������1�������˺�ϴ�ӣ������õ��IJ����������ձ�����������_____��ϴ�ӵ�Ŀ����________
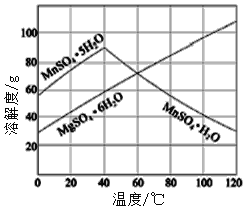
��7����֪�����̡�����þ�ᾧˮ������ܽ��������ͼ�������2����������Ũ����___________�����ˡ�ϴ�ӡ����
������Ӧ�ã�
��8����MnSO4�ɲⶨˮ���ܽ����������ǣ�ȡ100mL ˮ����Ѹ�ټ�������MnSO4��Һ������NaOH��KI��Һ�������������ӡ���ʹ֮��ַ�Ӧ�������ӣ�Ѹ�ټ���������ϡ���ᣬ��ʱ��I2���ɣ�����0.79gL��1Na2S2O3��Һ��I2��Ӧ��������Na2S2O3��Һ 12.0mLʱ��Ӧ��ȫ���йػ�ѧ��Ӧ����ʽ�£�
��2MnSO4+O2+4NaOH=2MnO(OH)2+2Na2SO4��
��MnO(OH)2 + 2KI + 2H2SO4 = MnSO4 + K2SO4 + I2 + 3H2O��
��I2 + 2Na2S2O3 = Na2S4O6 + 2NaI��
����ˮ�����ܽ�����Ũ�ȣ���mgL-1Ϊ��λ����д���������________��
����Ŀ��ijС��ͬѧ��Ʋ�����ʵ�飬̽��Ӱ���������ֽ����ʵ����ء�
����������裩Ӱ���������ֽ����ʵ����ؿ������¶ȡ���Һ��Ũ�ȡ��������ࡣ
��ʵ���¼��ͬѧ�ǽ���6��ʵ�飬ʵ���¼���£�
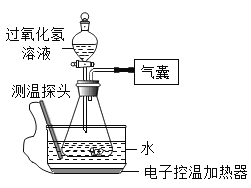
ʵ����� | �� | �� | �� | �� | �� | �� |
����������Һ��Ũ�ȣ�%�� | 30 | 30 | 15 | 30 | 30 | 30 |
����������Һ�������mL�� | 6 | x | 6 | 6 | 6 | 6 |
ˮ����ˮ���¶� | 20 | 90 | 70 | 70 | 20 | 20 |
��ƿ�е����� | 0.5g NaCl | 0.5g FeCl3 | ||||
60���ڲ���������mL�� | 0.0 | 41.0 | 4.5 | 12.1 | 2.0 | 650.0 |
����������ۣ�
��1��ʵ�����Ӧ�������������Һ�����x��________mL��
��2��ʵ��١���ͨ���ⶨ��ͬʱ���ڲ���������������ȽϹ�������ķֽ����ʣ�������ͨ���ⶨ__________���ȽϹ�������ķֽ����ʡ�
��3���ó�������������Һ��Ũ��Խ��ֽ�����Խ�������������ݵ�ʵ����__________������ţ���
��4��ͨ��ʵ��١��ڡ��ܿɵó��Ľ�����_______________��
����˼�����ۣ�
��5��ͬѧ����Ϊʵ������������Ӧѡ��ʵ�����ѡʵ��ڵ�������____________��____________�������㣩��
��6������ΪӰ�����������Һ�ֽ����ʵ����ػ�����Щ�������ʵ����֤��IJ���
��������裩___________________��
��ʵ�������___________________��
��ʵ����ۣ�___________________��