题目内容
【题目】化学促进科学技术发展
(1)新高能材料的研究
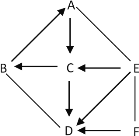
2017年1月27日,《科学》上报道我国科学家团队成功合成世界首个全氮阴离子盐,占领新一代超高能含能材料研究国际制高点。该盐可简略表示如左图,请仔细观察下图:
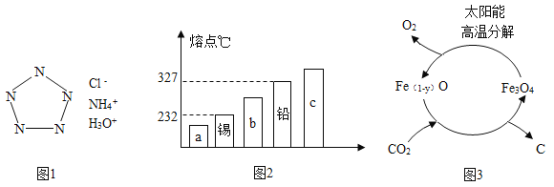
①由5个氮原子构成的全氮阴离子的符号是________。
②全氮阴离子盐化学式可表示为__________________。
(2)合金材料的研发
①合金的很多性能与组成它们的纯金属不同.图1能表示锡铅合金的是_____(填序号“a”“b”或“c”)。
②镁合金被誉为“21世纪绿色金属结构材料”。Mg17Al12是一种特殊的镁合金,通常选择真空熔炼而非空气中熔炼的原因是___________(任写一个化学方程式)。该合金是一种储氢材料,完全吸氢后得到MgH2和Al,“储氢过程”属于________(填“物理”或“化学”)变化。
(3)CO2的绿色利用
①目前处理CO2的一种方法是在催化剂作用下,利用H2使CO2转化为甲烷并得到水。该反应的化学方程式为_____________。
②如图2是以“铁氧化物”为催化剂,利用太阳能将CO2资源化利用的方法之一,这一转化过程中总的化学方程式可表示为______________。
【答案】N5- NH4N5HCl a 4Al+3O2![]() 2Al2O3或2Mg+O2
2Al2O3或2Mg+O2![]() 2MgO 化学 4H2+CO2
2MgO 化学 4H2+CO2 CH4+2H2O CO2
CH4+2H2O CO2 C+O2
C+O2
【解析】
(1)由图可知,全氮阴离子是由5个氮原子包围一个负电荷,故填写:N5-;
由图可知,全氮阴离子盐包含有N5-、NH4+、H+、Cl-,化学式为:NH4N5HCl,故填写:NH4N5HCl;
(2)根据合金的的硬度比组成它的纯金属大,熔点比其纯金属小的原则可知,锡铅合金的熔点比锡、铅小,故填写:a;
Mg17Al12需在真空中熔炼的原因是,金属镁和铝在熔炼过程中易与空气中的氧气反应,使生成Mg17Al12的原料减少,故填写:4Al+3O2![]() 2Al2O3或2Mg+O2
2Al2O3或2Mg+O2![]() 2MgO;
2MgO;
Mg17Al12完全吸氢后得到MgH2和Al,物质发生了变化,属于化学反应,故填写:化学;
(3)H2在催化剂作用下使CO2转化为甲烷并得到水,化学方程式为:4H2+CO2 CH4+2H2O;故填写:4H2+CO2
CH4+2H2O;故填写:4H2+CO2 CH4+2H2O;
CH4+2H2O;
由图2可知,Fe3O4和Fe(1-x)O,在两个反应后,是循环的,质量不变,总反应中不出现,总反应中的反应物为二氧化碳,生成物为碳和氧气,故填写:CO2 C+O2。
C+O2。

 口算题卡北京妇女儿童出版社系列答案
口算题卡北京妇女儿童出版社系列答案【题目】MnSO4H2O在工业、农业等方面有广泛的应用。
(一)制备:工业上用化工厂尾气中低浓度SO2与软锰矿(主要成分MnO2,杂质金属元素Mg、Al、Fe等)制备MnSO4H2O过程如下:
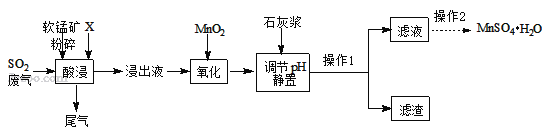
已知:浸出液中阳离子主要有H+、Mn2+、Mg2+、Fe2+、Al3+等;浸出过程中发生的主要反应化学方程式为:MnO2+SO2=MnSO4。
(1)生产中将软锰矿粉碎的目的是____。
(2)物质X最好选用_____。
a.盐酸 b.硫酸 c.硝酸
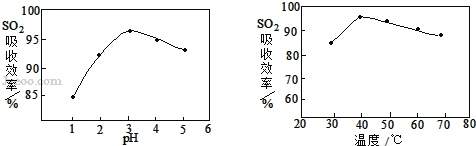
(3)酸浸时SO2的吸收效率与pH、温度的关系如下图所示,为提高SO2的吸收效率,酸浸时pH控制在____左右,温度控制在_________℃左右最适宜。
(4)流程中“氧化”步骤的目的是将Fe2+ 氧化为Fe3+,请完善反应的化学方程式MnO2+2FeSO4+_______ = MnSO4 + Fe2(SO4)3 + 2H2O 。
(5)加入石灰浆调节pH,可将氧化后的浸出液中杂质离子形成氢氧化物除去。
已知:(一)有关氢氧化物沉淀pH对应表
氢氧化物 | Fe(OH)3 | Al(OH)3 | Mn(OH)2 | Mg(OH)2 |
开始沉淀pH | 1.8 | 4.1 | 8.3 | 9.4 |
完全沉淀pH | 3.2 | 5.0 | 9.8 | 12.4 |
(二)Fe3+能与KSCN溶液作用显血红色则加石灰浆时应控制溶液的pH范围为_________。测定溶液的pH最好选____(a.pH试纸 b.pH计),检验Fe3+是否除尽的最佳方法是________。
(6)操作1包括过滤和洗涤,过滤用到的玻璃仪器有烧杯、玻璃棒和_____,洗涤的目的是________
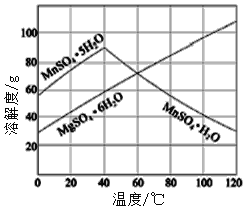
(7)已知硫酸锰、硫酸镁结晶水合物的溶解度曲线如图,则操作2包括:蒸发浓缩,___________,过滤、洗涤、干燥。
(二)应用:
(8)用MnSO4可测定水中溶解氧。方法是:取100mL 水样,迅速加入足量MnSO4溶液及含有NaOH的KI溶液,立即塞上塞子、振荡,使之充分反应;打开塞子,迅速加入适量的稀硫酸,此时有I2生成;再用0.79gL﹣1Na2S2O3溶液和I2反应,当消耗Na2S2O3溶液 12.0mL时反应完全。有关化学反应方程式下:
①2MnSO4+O2+4NaOH=2MnO(OH)2+2Na2SO4;
②MnO(OH)2 + 2KI + 2H2SO4 = MnSO4 + K2SO4 + I2 + 3H2O;
③I2 + 2Na2S2O3 = Na2S4O6 + 2NaI。
计算水样中溶解氧的浓度(以mgL-1为单位),写出计算过程________。