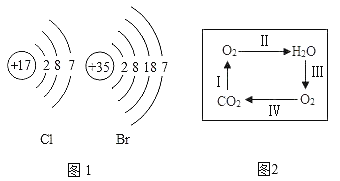
题目内容
【题目】某化学小组探究炼铁的反应原理。
(一)利用图装置回答问题(假设赤铁矿粉样品中的Fe2O3完全反应,赤铁矿中杂质不参与反应):
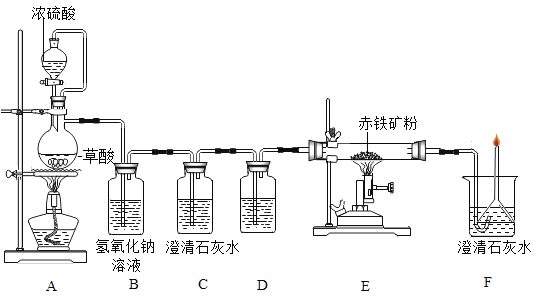
(1)A装置的作用是制取一氧化碳,反应的化学方程式为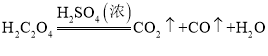 。根据反应装置判断,化学方程式中还缺少的条件是___________________。
。根据反应装置判断,化学方程式中还缺少的条件是___________________。
(2)C装置的作用是______,D装置中药品的名称是________,E装置中发生反应的化学方程式为________,F处将尾气燃烧掉的目的是______。
(3)实验中记录的数据如下表,据此计算赤铁矿中氧化铁的质量分数为________。
玻璃管质量 | 玻璃管和药品反应前质量 | 玻璃管和药品反应后质量 |
65.6g | 75.6g | 73.2g |
(4)有同学提出可以根据F装置中增加的质量来计算赤铁矿中氧化铁的质量,你同意此看法吗?
说出你的观点和理由是_______。
(二)利用图装置进行甲、乙对比实验,探究温度对CO和Fe2O3反应的影响(固定装置和尾气处理装置略,所用固体药品为纯净物)。
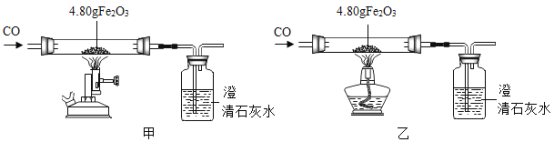
(1)反应过程中观察到,甲、乙两组的澄清石灰水均变浑浊,集气瓶中发生反应的化学方程式为________。
(2)完全反应后,甲、乙两组的生成物均为黑色粉末,分别用两组的生成物进行以下实验:
步骤 | 操作 | 甲组现象 | 乙组现象 |
1 | 称量黑色粉末质量/g | m1 | m2 |
2 | 取黑色粉末,用磁铁吸引 | 全部被吸引 | 全部被吸引 |
3 | 取黑色粉末,加入足量CuSO4溶液 | 黑色粉末溶解,有红色物质生成 | 无明显现象 |
(注:铁的氧化物中,只有Fe3O4能被磁铁吸引)
①甲组的黑色粉末与CuSO4溶液反应的化学方程式是_____。
②小明同学查阅资料后发现Fe3O4在常温下不与CuSO4溶液反应,故猜想乙组的生成物为Fe3O4。
小丽提出不同意见:假设乙组黑色粉末中除了有Fe3O4,还可能含有少量铁粉,铁粉的含量低,与硫酸铜溶液反应也可能无明显现象。
了进一步确定乙组生成物成分,小组同学提出,如果m2恰好为______________g,则小明的猜想正确,如果m2_____________________(填“大于”或“小于”)该质量,则乙组生成物中还含有少量铁粉。
【答案】加热 检验二氧化碳是否被氢氧化钠溶液完全吸收 浓硫酸 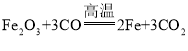 一氧化碳有毒,防止污染空气 80% 不同意,这是因为澄清石灰水中氢氧化钙很少,不一定把生成二氧化碳完全吸收,同时空气中的二氧化碳也能被澄清石灰水吸收
一氧化碳有毒,防止污染空气 80% 不同意,这是因为澄清石灰水中氢氧化钙很少,不一定把生成二氧化碳完全吸收,同时空气中的二氧化碳也能被澄清石灰水吸收 ![]()
![]() 4.64 小于
4.64 小于
【解析】
一氧化碳和氧化铁高温生成铁和二氧化碳,一氧化碳有毒,点燃生成二氧化碳,二氧化碳和氢氧化钙生成碳酸钙和水,铁和硫酸铜反应生成铜和硫酸亚铁。
(一)(1)由图可知,浓硫酸和草酸在加热条件下反应,故A装置的作用是制取一氧化碳,反应的化学方程式为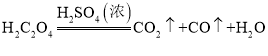 。根据反应装置判断,化学方程式中还缺少的条件是加热。
。根据反应装置判断,化学方程式中还缺少的条件是加热。
(2)浓硫酸和草酸在加热条件下反应生成二氧化碳,B装置中二氧化碳和氢氧化钠反应生成碳酸钠和水,二氧化碳能使澄清石灰水变浑浊,常用于检验二氧化碳气体,故C装置的作用是检验二氧化碳是否被氢氧化钠溶液完全吸收,D装置是干燥气体,浓硫酸具有吸水性,故D装置中药品的名称是浓硫酸,E装置中发生反应是一氧化碳和氧化铁高温生成铁和二氧化碳,故反应的化学方程式为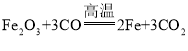 ,一氧化碳有毒,点燃生成二氧化碳,故F处将尾气燃烧掉的目的是一氧化碳有毒,防止污染空气。
,一氧化碳有毒,点燃生成二氧化碳,故F处将尾气燃烧掉的目的是一氧化碳有毒,防止污染空气。
(3)一氧化碳和氧化铁反应生成铁和二氧化碳,由质量守恒定律可知,反应前后元素的质量不变,则氧化铁中氧元素的质量为![]() ,氧化铁的质量为
,氧化铁的质量为![]() ,故赤铁矿中氧化铁的质量分数为
,故赤铁矿中氧化铁的质量分数为![]() 。
。
(4)澄清石灰水吸收二氧化碳气体的质量很少,故不同意,理由是澄清石灰水中氢氧化钙很少,不一定把生成二氧化碳完全吸收,同时空气中的二氧化碳也能被澄清石灰水吸收。
(二)(1)反应过程中观察到,甲、乙两组的澄清石灰水均变浑浊,说明反应生成二氧化碳,集气瓶中发生反应是二氧化碳和氢氧化钙生成碳酸钙和水,故反应的化学方程式为![]() 。
。
(2)①甲组中一氧化碳和氧化铁高温生成铁和二氧化碳,则甲组的黑色粉末与CuSO4溶液反应生成铜和硫酸亚铁,故反应的化学方程式是![]() 。
。
②小明同学查阅资料后发现Fe3O4在常温下不与CuSO4溶液反应,猜想乙组的生成物为Fe3O4,则![]() ,故如果m2恰好为4.64g, 则小明的猜想正确,铁和硫酸铜反应生成硫酸亚铁和铜,则质量减少,故如果m2小于该质量,则乙组生成物中还含有少量铁粉。
,故如果m2恰好为4.64g, 则小明的猜想正确,铁和硫酸铜反应生成硫酸亚铁和铜,则质量减少,故如果m2小于该质量,则乙组生成物中还含有少量铁粉。

【题目】某同学学习CO2的制取和性质时,设计了下列实验探究内容。按要求答题。
(1)不同实验对反应速率有不同要求。从所提供的限选选项中选择合适选项填写下表:
限选控制反应速率的方法:①反应物的浓度 ②反应物的状态 ③催化剂
限选试剂:A稀盐酸 B浓盐酸 C块状石灰石 D碳酸钠溶液 E粉末状石灰石 F二氧化锰G.H2O2溶液
实验名称 | 所选用的最佳试剂 | 控制速率的方法 |
过氧化氢制氧气(示例) | G和F | ③ |
CO2的实验室制法 | A和_______ | ________ |
(2)为探究SO2与CO2的性质异同,设计了如下实验:在水槽中注入一定体积的蒸馏水,并向其中滴加几滴试剂X,然后将分别集满SO2和CO2两种气体的试管同时倒立于水槽中,片刻后实验现象如右图所示,试管内溶液变成红色。请完成下面的实验报告:
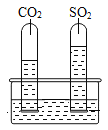
①SO2与CO2一样可溶于水,溶解性SO2_____CO2(填“>”或“<”或“=”)。
②SO2与CO2一样与水反应,均生成了有酸性的物质,X是______。
【题目】某化学兴趣小组为了验证质量守恒定律,做了镁条在空气中燃烧的实验。
(1)小明发现燃烧产物的质量大于反应物镁条的质量,认为这个反应不遵守质量守恒定律,我_____(填“同意”或“不同意”)小明的观点,因为_____。
(2)小红按下图装置改进实验,验证了质量守恒定律,却发现产物中还有少量黄色固体。
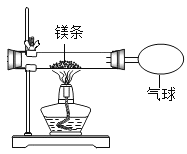
(提出问题)黄色固体是什么呢?
(查阅资料)①氧化镁为白色固体;
②镁能与氮气剧烈反应生成黄色的氮化镁(Mg3N2)固体,写出氮气和镁反应的化学方程式_____;
③氮化镁可与水剧烈反应产生氨气,该气体能使湿润的红色石蕊试纸变蓝。
(实验操作)
操作步骤 | 实验现象 | 实验结论 |
_____ | _____ | 黄色固体为Mg3N2 |
(做出猜想)黄色固体是Mg3N2
(实验探究)请设计实验,验证猜想
(反思与交流)空气中N2的含量远大于O2的含量,而镁条在空气中燃烧生成的MgO却远多于Mg3N2,为什么呢?请给出合理的解释_____。
【题目】小金在配制硝酸钾溶液时得到下表数据,据此分析以下说法正确的是( )
序号 | 温度/℃ | 水的质量/克 | 加入硝酸钾的质量/克 | 所得溶液的质量/克 |
① | 10 | 100 | 40 | 120.9 |
② | 60 | 100 | 40 | 140 |
A.10℃时硝酸钾的溶解度为40克
B.②所得溶液一定是60℃时硝酸钾的饱和溶液
C.若通过加热将①中剩余硝酸钾全部溶解,则溶液的溶质质量分数与加热前保持一致
D.若将②所得溶液降温至10℃,则溶液的溶质质量分数会变小
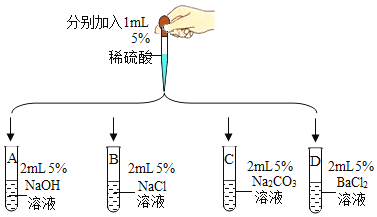
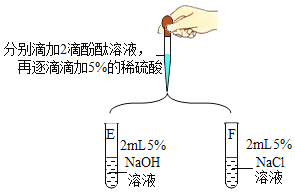
【题目】某同学设计如下几组实验,探究某些酸、碱、盐之间的复分解反应能否发生。
已知:BaSO4是白色固体,难溶于水,也不与盐酸反应。
(第一组)选取5种溶液,如图所示进行实验。
实验 | 现象及结论 | 解释 |
| 试管A和B中无明显现象,不能确定反应是否发生。 | / |
(1)试管C中产生_____(填实验现象)。复分解反应已发生。 | (2)试管C中减少的微粒是_____ (填微粒符号) | |
试管D中有白色沉淀产生。复分解反应已发生。 | (3)反应的化学方程式为_____ |
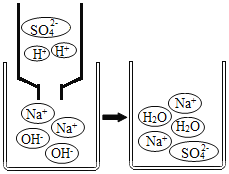
(第二组)对试管A和B中是否发生反应再探究,如图所示进行实验。
实验 | 现象及结论 | 解释 |
| 试管E中,滴加酚酞试液后,溶液由无色变为红色;滴加一定量稀硫酸后,溶液由红色变为无色。复分解反应已发生。 |
(4)从微观粒子变化的角度分析试管E中反应的实质是_____。 |
试管F中始终无明显现象,不能确定反应是否发生。 |
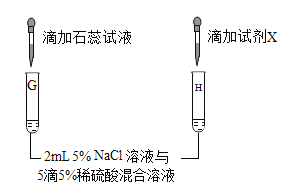
(第三组)对试管B中是否发生反应继续探究,如图所示进行实验。
实验 | 现象及结论 | 解释 |
| 试管G中溶液变红 | (5)该实验的目的是为了检验试管G的溶液中存在_____(填微粒符号)。 |
(6)向试管H中滴加_____(填“试剂X”的化学式)溶液后,有白色沉淀产生。 | 溶液中有SO42﹣存在。 | |
结论 | NaCl溶液与稀硫酸不发生复分解反应。 | |