��Ŀ����
����Ŀ���������߽���ѧ���ӻ�ѧ������ᣮ��ӻ�ѧ���ӽ���ʶ�����е��й����⣮
![]() ���ﳴ��ʱ���Ż���õ������________��
���ﳴ��ʱ���Ż���õ������________��
![]() ijͬѧ�����ʳ�����£�����ʳ��������ʳ�������������⡱�����и������۵���________��
ijͬѧ�����ʳ�����£�����ʳ��������ʳ�������������⡱�����и������۵���________��
![]() ʳ��������Ҫ�ĵ�ζƷ���±�Ϊʳ���ڲ�ͬ�¶��µ��ܽ�ȣ���ϱ�����Ϣ�ش��������⣺
ʳ��������Ҫ�ĵ�ζƷ���±�Ϊʳ���ڲ�ͬ�¶��µ��ܽ�ȣ���ϱ�����Ϣ�ش��������⣺
�¶� |
|
|
|
|
|
|
�ܽ�� |
|
|
|
|
|
|
�ٹ���ʳ�ε�����________��
�ڴӽӽ����͵�ʳ����Һ�л��ʳ�ξ��壬Ӧ��ȡ�ķ�����________��
��![]() ʱ����
ʱ����![]() ˮ�м���
ˮ�м���![]() ʳ�Σ���ֽ��裬������Һ��������________��
ʳ�Σ���ֽ��裬������Һ��������________��
![]() ����Ʒ����ʹ���������⣬�������������________��
����Ʒ����ʹ���������⣬�������������________��
�ճ������з�ֹ����Ʒ��ʴ�ķ�����________��
![]() ����ˮ����ˮ�����г��û���̿������̿����Ҫ������________��
����ˮ����ˮ�����г��û���̿������̿����Ҫ������________��
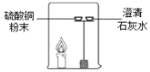
![]() ����ʦ���и�����ʱ����������ͭ��Һ�������ϻ��������º�ɫ��ӡ�����˹����з�����Ӧ�Ļ�ѧ����ʽΪ________��
����ʦ���и�����ʱ����������ͭ��Һ�������ϻ��������º�ɫ��ӡ�����˹����з�����Ӧ�Ļ�ѧ����ʽΪ________��
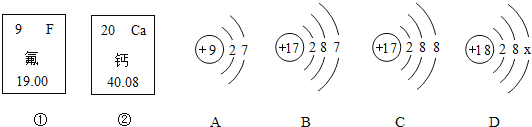
���𰸡��ù��Ǹ�����![]() ��
��![]() �����ᾧ
�����ᾧ![]() ��������ˮ�Ӵ�ˢ���Ϳ������
��������ˮ�Ӵ�ˢ���Ϳ������![]()
��������
��1�����Ż�ʱ���ù��Ǹ�������õĴ����취��
��2�����и������ۣ�
��3����ʳ�ε���Ҫ�ɷ����Ȼ��ƣ��Ȼ����������ͻ������˹����Ȼ��Ƶ���С���������Ӻ������ӣ�
���Ȼ��Ƶ��ܽ�����¶ȱ仯��С����˴ӽӽ����͵�ʳ����Һ�л��ʳ�ξ��壬Ӧ��ȡ�ķ����������ᾧ��
��20Cʱ���Ȼ��Ƶ��ܽ����36g�������100gˮ�м���40gʳ�Σ���ֽ��裬�����ܽ��Ȼ���36g��������Һ��������136g��
��4������������ˮͬʱ�Ӵ�ʱ�����⣬����ͨ��ˢ����ķ�ʽ����������������ˮ�����
��5������̿����Ҫ����������ˮ�е���ζ��ɫ�أ�
��6���ù����У�����ͭ����������Ӧ����Ӧ����ʽ��![]() ����ɫ������������ͭ���ʡ�
����ɫ������������ͭ���ʡ�

����Ŀ��Ӣ����ѧ�ҷ�������������Ϊ����,�������귢����һϵ���� ��,���ݽ����ݱ���ɡ�����Ļ�ѧʷ��һ�顣ij��ѧС��������ȼ�չ� �̽�������һ��̽����
���������ϣ�����ͭ( CuSO4)��һ�ְ�ɫ��ĩ,������ˮ��,��ˮ���Ϊ��ɫ��
������ʵ�飩
��� | ʵ�鲽�� | ʵ������ | ʵ����� |
1 |
| ���洦����ɴ�����ֺ��ȵ� ��,���漰���Ĵ�����ɴ���� ���Ա仯�� | _____ |
2 |
| ���� ���� �� ������ �������̣�_____ | ���Ĵ���______�� ���� |
3 |
| ����ȼ�ղ������� ˮ�Ͷ�����̼ |
��1��ʵ�� 1�õ��Ľ�����______��
��2����ȫʵ�� 2��ʵ������______��
��3��ʵ�� 3�У�����ͭ��ĩ��������______���õ�������ȼ�յIJ����к��ж�����̼����һ��������Ӧ��ʵ��������______��
����˼�����ۣ�
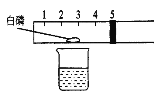
��4��ʵ�� 3�Ǹ�С��ͬѧ����ͼ��ʾʵ��ĸĽ�������ͼ��ʾʵ����ȣ�ʵ�� 3 ���ŵ���______��
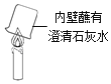
��5���ڸ�ʵ���У����������ۻ���ȼ�գ������ֱ仯����������______��