题目内容
【题目】水是常用的溶剂,请根据图一实验现象和图二的甲、乙溶解度曲线回答下列问题:
(1)图一实验,若探究甲、乙的溶解性的同时还想硏究甲、乙两种物质分别溶于水过程中的热量变化,请你重新设计实验,简述实验操作_____。
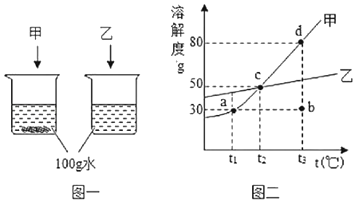
(2)①t1℃时,甲物质的溶解度是_____g;
②图二中,甲物质的四种溶液状态“a、b、c、d”中,处于不饱和状态的是_____(填编号);
③t1℃时,将l5g甲加入到_____g水中,完全溶解后,恰好得到饱和溶液;为了进一步提高该溶液的溶质质量分数,可进行的操作是_____;
④取甲、乙的混合物100g溶于100g热水,待冷却到t2℃,若甲析出而乙不析出,则混合物中甲的质量分数ω的取值范围是_____。
【答案】取两个烧杯个取100mL的水,测定温度,将等质量的甲乙物质物质分别加入烧杯中,用玻璃棒搅拌至不再溶解,测定溶液的温度 30 b 50 升高温度并加入甲物质 50%<ω<100%
【解析】
(1)若探究甲、乙的溶解性的同时还想硏究甲、乙两种物质分别溶于水过程中的热量变化,应进行的实验操作是:取两个烧杯个取100mL的水,测定温度,将等质量的甲乙物质物质分别加入烧杯中,用玻璃棒搅拌至不再溶解,测定溶液的温度。
(2)①由甲物质的溶解度曲线可知,t1℃时,甲物质的溶解度是30g;
②由甲物质的溶解度曲线的意义可知,甲物质的四种溶液状态“a、b、c、d”中,处于不饱和状态的是b;
③由甲物质的溶解度曲线的意义可知,t1℃时,甲物质的溶解度是30g,将l5g甲加入到50g水中,完全溶解后,恰好得到饱和溶液;
为了进一步提高该溶液的溶质质量分数,由于甲物质的溶解度随温度的升高而增大,可进行的操作是升高温度并加入甲物质;
④由甲、乙的溶解度曲线可知,在t2℃是溶解度相等都是50g,取甲、乙的混合物100g溶于100g热水,待冷却到t2℃,若甲析出而乙不析出,可知甲物质至少要大于50g但肯定小于100g,则混合物中甲的质量分数ω的取值范围是50%<ω<100%。

【题目】实验小组研究制备Cu(OH)2的条件并探究其稳定性。
(查阅资料)两种含铜化合物的部分性质如下表所示。
化合物 | Cu(OH)2 | Cu4(OH)6SO4 | CuO |
颜色 | 蓝色 | 绿色 | 黑色 |
在水中的溶解性 | 难溶 | 难溶 | 难溶 |
(进行实验)
实验1:室温下,取16%CuSO4溶液和4%NaOH溶液进行实验。
| 序号 | CuSO4溶液体积/mL | NaOH溶液体积/mL | 实验现象 |
1-1 | 2 | 2 | 产生浅绿色沉淀 | |
1-2 | 2 | 4 | 产生蓝色沉淀 混有少量浅绿色沉淀 | |
1-3 | 2 | 6 | 产生蓝色沉淀 |
实验2:将1-3所得混合物过滤,得到蓝色沉淀,将沉淀洗涤、干燥后置于恒温烘箱中,3h后观察并记录实验现象。
序号 | 2-1 | 2-2 | 2-3 | 2-4 | 2-5 |
烘箱温度/oC | 40 | 50 | 60 | 70 | 80 |
固体是否变黑 | 不变黑 | 不变黑 | 不变黑 | 变黑 | 变黑 |
实验3: 重复实验1-3,将所得混合物置于不同水浴温度下,记录实验现象。
序号 | 3-1 | 3-2 | 3-3 | 3-4 |
水浴温度/oC | 0 | 30 | 60 | 90 |
出现黑色沉淀的时间 | 1h | 3min | 25s | 2s |
(解释与结论)
(1)CuSO4溶液与NaOH溶液反应制Cu(OH)2的化学方程式为_____。
(2)实验1-1反应得到浅绿色沉淀的主要成分是______。
(3)由实验1
(4)实验2固体变黑的原因是_____(用化学方程式解释)。
(5)实验3的结论是_____。
(反思与评价)
(6)对比实验2和实验3,得出的结论是_____。