题目内容
【题目】某纯碱样品中含有少量氯化钠.为测定样品中碳酸钠的质量分数,现称取该样品11g,加入到盛有50g稀盐酸的烧杯中,恰好完全反应,最后称得烧杯中溶液的质量为56.6g.计算:
(1)产生二氧化碳的质量是_____g
(2)纯碱样品中碳酸钠的质量分数;____
(3)反应后所得溶液中溶质的质量分数.____
【答案】4.4 96.4% 21.4%
【解析】
反应前后的质量差即为反应生成二氧化碳的质量,根据二氧化碳的质量可以计算碳酸钠的质量和生成的氯化钠的质量,进一步可以计算纯碱样品中碳酸钠的质量分数和反应后所得溶液中溶质的质量分数。
解:(1)生成二氧化碳的质量为:11g+50g﹣56.6g=4.4g;
(2)设碳酸钠的质量为x,生成氯化钠的质量为y,
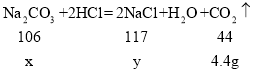
![]() x=10.6g,
x=10.6g,
![]() y=11.7g,
y=11.7g,
纯碱样品中碳酸钠的质量分数为:![]() ×100%
×100%![]() 96.4%;
96.4%;
(3)反应后所得溶液中溶质的质量分数为:![]() ×100%
×100%![]() 21.4%。
21.4%。

练习册系列答案
相关题目