题目内容
【题目】实验小组研究制备Cu(OH)2的条件并探究其稳定性。
(查阅资料)两种含铜化合物的部分性质如下表所示。
化合物 | Cu(OH)2 | Cu4(OH)6SO4 | CuO |
颜色 | 蓝色 | 绿色 | 黑色 |
在水中的溶解性 | 难溶 | 难溶 | 难溶 |
(进行实验)
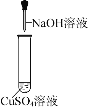
实验1:室温下,取16%CuSO4溶液和4%NaOH溶液进行实验。
| 序号 | CuSO4溶液体积/mL | NaOH溶液体积/mL | 实验现象 |
1-1 | 2 | 2 | 产生浅绿色沉淀 | |
1-2 | 2 | 4 | 产生蓝色沉淀 混有少量浅绿色沉淀 | |
1-3 | 2 | 6 | 产生蓝色沉淀 |
实验2:将1-3所得混合物过滤,得到蓝色沉淀,将沉淀洗涤、干燥后置于恒温烘箱中,3h后观察并记录实验现象。
序号 | 2-1 | 2-2 | 2-3 | 2-4 | 2-5 |
烘箱温度/oC | 40 | 50 | 60 | 70 | 80 |
固体是否变黑 | 不变黑 | 不变黑 | 不变黑 | 变黑 | 变黑 |
实验3: 重复实验1-3,将所得混合物置于不同水浴温度下,记录实验现象。
序号 | 3-1 | 3-2 | 3-3 | 3-4 |
水浴温度/oC | 0 | 30 | 60 | 90 |
出现黑色沉淀的时间 | 1h | 3min | 25s | 2s |
(解释与结论)
(1)CuSO4溶液与NaOH溶液反应制Cu(OH)2的化学方程式为_____。
(2)实验1-1反应得到浅绿色沉淀的主要成分是______。
(3)由实验1
(4)实验2固体变黑的原因是_____(用化学方程式解释)。
(5)实验3的结论是_____。
(反思与评价)
(6)对比实验2和实验3,得出的结论是_____。
【答案】CuSO4+2NaOH=Cu(OH)2↓+Na2SO4 Cu4(OH)6SO4 16%CuSO4溶液与4%NaOH溶液的体积比为1:3 Cu(OH)2![]() CuO+H2O Cu(OH)2在有水的环境中可分解生成氧化铜,温度越高,分解越快 Cu(OH)2不稳定,在有水的环境中比在干燥的环境中更容易分解
CuO+H2O Cu(OH)2在有水的环境中可分解生成氧化铜,温度越高,分解越快 Cu(OH)2不稳定,在有水的环境中比在干燥的环境中更容易分解
【解析】
[解释与结论]
(1)CuSO4溶液与NaOH溶液反应生成蓝色的Cu(OH)2沉淀和硫酸钠,反应的化学方程式为CuSO4+2NaOH= Cu(OH)2↓+ Na2SO4;
(2)根据资料提供信息可知Cu4(OH)6SO4为难溶于水的绿色沉淀,则实验1-1反应得到浅绿色沉淀的主要成分是Cu4(OH)6SO4;
(3)根据实验1的三组实验可知,16%CuSO4溶液与4%NaOH溶液的体积比为1∶1时生成绿色沉淀(Cu4(OH)6SO4);1∶2时产生蓝色沉淀并混有少量浅绿色沉淀(Cu(OH)2和Cu4(OH)6SO4);1∶3时,产生蓝色沉淀(Cu(OH)2);可得出制备蓝色的Cu(OH)2应控制的条件是16%CuSO4溶液与4%NaOH溶液的体积比为1∶3;
(4)实验2将蓝色沉淀洗涤、干燥后置于恒温烘箱中,固体变黑的原因是氢氧化铜受热分解生成了黑色的氧化铜,反应的化学方程式为Cu(OH)2![]() CuO+H2O ;
CuO+H2O ;
(5)根据实验3数据可知,温度越高出现黑色沉淀的时间越短,说明Cu(OH)2在有水的环境中可分解生成氧化铜,温度越高,分解越快;
[反思与评价]
(6)实验2中烘箱温度达到70℃时氢氧化铜才能变黑,而实验3中,水浴温度在30℃时氢氧化铜就能快速变黑(3分钟),所以对比实验2和实验3,得出的结论是Cu(OH)2不稳定,在有水的环境中比在干燥的环境中更容易分解。

【题目】2019年苏州市初中化学实验考查内容是“用高锰酸钾制取氧气”(装置图如下),下面是某同学在本次实验过程中填写的部分实验报告,请回答有关问题:
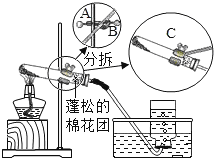
实验步骤 | 有关问题 |
⑴检查气体发生装置的气密性。 | 检查装置气密性的具体操作及气密性良好的判断依据是_____。 |
⑵向试管中加入少量高锰酸钾粉末,使其平铺于试管底部,按上图所示组装实验装置。在接近试管口的地方放置一小团蓬松的棉花团。 | ①用药匙或纸槽向试管中加入少量高锰酸钾粉末。 ②组装实验装置时,要根据___的高度将盛有药品的试管固定在铁架台上。 ③欲调整装置中试管的倾斜角度,应调节图中A、B、C哪个旋钮:___旋钮。 ④试管口棉花团的作用是____。 |
实验步骤 | 有关问题 |
⑶加热试管,当导管口有连续均匀气泡冒出时,开始收集气体。 | ①加热试管的方法是____。 ②发生反应的化学方程式为____。 ③收集满瓶氧气的操作过程是:等集气瓶中的水排完后,一只手扶稳集气瓶,另一只手首先小心地将导管从瓶口移开,然后___,最后把集气瓶正放在桌子上。 |
⑷气体收集完毕后,操作B | 操作B是先____,再_____ |
⑸收集完气体后,测得其纯度明显偏低,其原因可能是____(填字母)。
A 高锰酸钾中混入了二氧化锰 B 收集前,集气瓶中未注满水
C 收集后,集气瓶中仍留有水 D 未见气泡连续均匀冒出时就开始收集
⑹选择排水法收集一瓶氧气,供“铁丝在氧气中燃烧”实验使用的理由是____。
⑺)加热3.16g高锰酸钾固体一段时间,若高锰酸钾中的氧元素有1/4转化为氧气,则生成的氧气的质量为____,剩余固体中氧元素的质量分数为____。(精确到0.1%)
⑻林同学称取一定质量高锰酸钾制取一定质量的氧气,将温度控制在250℃加热制O2,实验结束时,林同学发现在用高锰酸钾制取氧气的实验中,收集到的O2大于理论产量,针对这一现象,同学们在老师的指导下进行了如下探究:
(提出猜想)依据质量守恒定律,他们做出如下猜想:
猜想Ⅰ:反应生成的MnO2分解放出O2
猜想Ⅱ:反应生成的K2MnO4分解放出O2
(实验验证)同学们分为两组,分别进行以下实验:
①第一组同学取一定质量的MnO2,在250℃条件下加热一段时间,冷却后测得MnO2的质量不变。则猜想____错误。
②第二组同学取一定质量的K2MnO4在250℃条件下加热,固体质量____(填“减轻”或“增重”),得出了猜想Ⅱ正确的结论。
林同学提出:不用测定质量也能验证以上猜想是否正确,林同学选择的实验方法可能是____。
(拓展延伸)实验发现,K2MnO4受热只能部分分解,经分析可能是K2MnO4分解的生成物K2O对其分解产生影响。为验证此结论,设计如下实验方案:
①分别取K2MnO4固体于两支试管中,一支试管中加入K2O,一支试管中不加K2O。
②加热,用相同规格的集气瓶,用排水法分别收集一瓶气体。③比较所用的时间长短,以确定锰酸钾的分解是否与氧化钾有关系。该过程中还必须控制相同的变量是______。