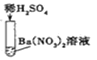��Ŀ����
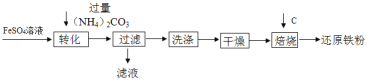
����Ŀ����ҵ�����������Ѱĸ���Ʒ���������Ʊ���ԭ���۵�������ͼ
����˵������ȷ����
A. ��ת����ʱ����Һ��������FeCO3�������÷�Ӧ�Ļ�����Ӧ�����Ǹ��ֽⷴӦ��
B. ����������õ�����Һ�е�����ֻ��(NH4)2SO4��
C. ����������������������FeCO3ת��ΪFeOOH��CO2����ʱ��FeCO3��Ӧ��������O2��H2O��
D. ȡ14.06g��ԭ����(������Fe������FexC)���������г�ּ��ȣ��õ�0.22gCO2����ȡ��ͬ�����Ļ�ԭ����������ϡ�����ַ�Ӧ(FexC��ϡ�����Ӧ)���õ�0.48gH2����FexC�Ļ�ѧʽ��Fe3C��
���𰸡�BD
��������
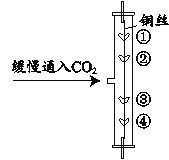
����������̼��立�Ӧ����̼����������������泥�����̼��粒��������˺�õ�����Һ�е�����������狀�̼��泥�ͨ��ϴ�Ӹ��������![]() ת��Ϊ
ת��Ϊ![]() ��
��![]() ��̼��������ת��Ϊ��ԭ�����ۡ�
��̼��������ת��Ϊ��ԭ�����ۡ�
A������������̼��立�Ӧ����̼����������������泥���ת����ʱ����Һ��������![]() ��������Ӧ�������ֻ�����������ɷ֣���÷�Ӧ�Ļ�����Ӧ�����Ǹ��ֽⷴӦ����A��ȷ�����������⣻
��������Ӧ�������ֻ�����������ɷ֣���÷�Ӧ�Ļ�����Ӧ�����Ǹ��ֽⷴӦ����A��ȷ�����������⣻
B������̼��粒��������˺�õ�����Һ�е�����������狀�̼��泥���B����ȷ���������⣻
C�� ����������������������![]() ת��Ϊ
ת��Ϊ![]() ��
��![]() ����ʱ��
����ʱ��![]() ��Ӧ��������
��Ӧ��������![]() ��
��![]() ����C��ȷ�����������⣻
����C��ȷ�����������⣻
D��0.22g������̼������̼Ԫ�ص�����Ϊ![]() ��������0.48g������Ҫ������������Ϊa
��������0.48g������Ҫ������������Ϊa
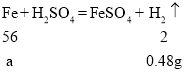
![]()
![]()
��![]() ����Ԫ�ص�����Ϊ
����Ԫ�ص�����Ϊ![]() ��
��![]() ������̼Ԫ�ص�������Ϊ
������̼Ԫ�ص�������Ϊ
![]() ����
����![]() ����
����![]() �Ļ�ѧʽΪ
�Ļ�ѧʽΪ![]() ����D����ȷ���������⡣��ѡBD��
����D����ȷ���������⡣��ѡBD��

 �¿α�����Ķ�ѵ��ϵ�д�
�¿α�����Ķ�ѵ��ϵ�д� ������������Ӧ����ϵ�д�
������������Ӧ����ϵ�д� ͬ����չ�Ķ�ϵ�д�
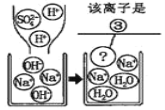
ͬ����չ�Ķ�ϵ�д�����Ŀ��ij��ѧ��ȤС���ͬѧ����ʵ������̽��ijЩ�ᡢ���֮���� �������ֽⷴӦ��
���������ϣ����ᱵ(BaSO4)��ɫ���壬������ˮ��Ҳ�������ᡣ
��ʵ����̽����
���� | ���� | ʵ����� | ���� | |
ʵ��һ |
| ��________ | ��ѧ����ʽ��: K2CO3+H2SO4=K2SO4+H2O+CO2�� | �������� ������� �Т�____ ���г��� ����ʱ, ���ֽⷴ Ӧ���Է� ���� |
ʵ��� | ������ϡ����
| ��Һ��ɫ �ɺ�ɫǡ �ñ�Ϊ�� ɫ |
| |
ʵ���� |
| ������ɫ ���� | �÷�Ӧ��ʵ����:Ba2++SO42-=BaSO4�� |
ʵ����������,ijͬѧ���ں���,��ʵ�����Թ�����ϲ���Һ a ������һ֧�ྻ���Թ���,����Һ a ����εμ� K2CO3 ��Һ���ڵμӹ����У������Ȳ� �����ݣ�Ȼ���ֲ�����ɫ������������������,�����ж�ԭ��Һ a �е���������______��
����չ����ϡ���ᡢCa(OH)2 ��Һ��NaCl ��Һ��Na2CO3 ��Һ����������Һ�� ���,д���ܷ�����Ӧ���г������ɵĻ�ѧ����ʽ______��
����˼�����ֽⷴӦ��ʵ���dz��ŵ�λ�����______���������� ���ƣ���Ŀ��С�ķ�����С�
����Ŀ��2019�������г��л�ѧʵ�鿼�����������ø��������ȡ������(װ��ͼ����)��������ijͬѧ�ڱ���ʵ���������д�IJ���ʵ�鱨�棬��ش��й����⣺
ʵ�鲽�� | �й����� |
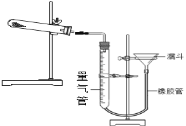
�ż�����巢��װ�õ������ԡ� | ���װ�������Եľ�����������������õ��ж�������_____�� |
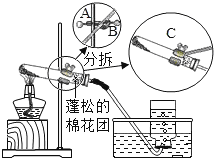
�����Թ��м�������������ط�ĩ��ʹ��ƽ�����Թܵײ�������ͼ��ʾ��װʵ��װ�á��ڽӽ��Թܿڵĵط�����һС�����ɵ����š� | ����ҩ��ֽ�����Թ��м�������������ط�ĩ�� ����װʵ��װ��ʱ��Ҫ����___�ĸ߶Ƚ�ʢ��ҩƷ���Թ̶ܹ�������̨�ϡ� ��������װ�����Թܵ���б�Ƕȣ�Ӧ����ͼ��A��B��C�ĸ���ť��___��ť�� ���Թܿ����ŵ�������____�� |
ʵ�鲽�� | �й����� |
�Ǽ����Թܣ������ܿ���������������ð��ʱ����ʼ�ռ����塣 | �ټ����Թܵķ�����____�� �ڷ�����Ӧ�Ļ�ѧ����ʽΪ____�� ���ռ���ƿ�����IJ��������ǣ��ȼ���ƿ�е�ˮ�����һֻ�ַ��ȼ���ƿ����һֻ������С�ĵؽ����ܴ�ƿ���ƿ���Ȼ��___�����Ѽ���ƿ�����������ϡ� |
�������ռ���Ϻ���B | ����B����____����_____ |
���ռ����������䴿������ƫ�ͣ���ԭ�������____(����ĸ)��
A ��������л����˶������� B �ռ�ǰ������ƿ��δע��ˮ
C �ռ�����ƿ��������ˮ D δ��������������ð��ʱ�Ϳ�ʼ�ռ�
��ѡ����ˮ���ռ�һƿ������������˿��������ȼ����ʵ��ʹ�õ�������____��
��)����3.16g������ع���һ��ʱ�䣬����������е���Ԫ����1/4ת��Ϊ�����������ɵ�����������Ϊ____��ʣ���������Ԫ�ص���������Ϊ____��(��ȷ��0.1%)
����ͬѧ��ȡһ���������������ȡһ�����������������¶ȿ�����250�������O2��ʵ�����ʱ����ͬѧ�������ø��������ȡ������ʵ���У��ռ�����O2�������۲����������һ����ͬѧ������ʦ��ָ���½���������̽����
��������룩���������غ㶨�ɣ������������²��룺
�����Ӧ���ɵ�MnO2�ֽ�ų�O2
�����Ӧ���ɵ�K2MnO4�ֽ�ų�O2
��ʵ����֤��ͬѧ�Ƿ�Ϊ���飬�ֱ��������ʵ�飺
�ٵ�һ��ͬѧȡһ��������MnO2����250�������¼���һ��ʱ�䣬��ȴ����MnO2���������䡣�����____����
�ڵڶ���ͬѧȡһ��������K2MnO4��250�������¼��ȣ���������____(��������������������)���ó��˲������ȷ�Ľ��ۡ�
��ͬѧ��������òⶨ����Ҳ����֤���ϲ����Ƿ���ȷ����ͬѧѡ���ʵ�鷽��������____��
����չ���죩ʵ�鷢�֣�K2MnO4����ֻ�ܲ��ַֽ⣬������������K2MnO4�ֽ��������K2O����ֽ����Ӱ�졣Ϊ��֤�˽��ۣ��������ʵ�鷽����
�ٷֱ�ȡK2MnO4��������֧�Թ��У�һ֧�Թ��м���K2O��һ֧�Թ��в���K2O��
�ڼ��ȣ�����ͬ���ļ���ƿ������ˮ���ֱ��ռ�һƿ���塣�۱Ƚ����õ�ʱ�䳤�̣���ȷ������صķֽ��Ƿ����������й�ϵ���ù����л����������ͬ�ı�����______��