题目内容
【题目】若 Na2SO3已部分被氧化变质,某同学为测定 Na2SO3样品的质量分数,设计实验方 案如下:
(方案一)沉淀法 主要操作流程图如下:

请回答下列问题:
(1)流程图中②、③的操作名称分别为②______、③______。
(方案二)测 SO2质量法 主要实验步骤如下:
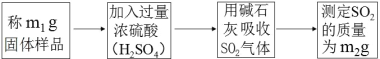
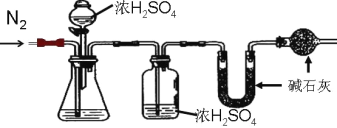
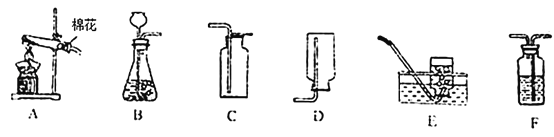
装置如图所示:
(1)该同学设计实验方案的反应原理为_____(用方程式表示)。
(2)装置中干燥管的作用是什么?_____。
(3)反应前和反应后都要吹入氮气的目的是什么?_____。
(4)样品中 Na2SO3 的质量分数的表达式为_____(用 m1、m2 表示)。
【答案】洗涤、干燥或烘干H2SO4(浓)+Na2SO3 = H2O + SO2↑+ Na2SO4防止空气中的水蒸气进入U 型管装置中,对实验造成干扰 。反应前一般先用氮气排尽装置内的空气,防装置内空气影响;反应后用氮气把反应 产生的残留在容器内的 SO2 气体全部导入 U 型管吸收装置中,确保反应产生的气体被全部吸收。![]()
【解析】
本题考查了测定物质的组成。根据实验目的和实验原理进行分析,综合性较强,仔细审题,弄清题意,灵活运用所学的知识。亚硫酸钠在空气中易氧化为硫酸钠,亚硫酸钠与盐酸反应生成氯化钠和水和二氧化硫;亚硫酸钠与硫酸反应生成硫酸钠和水和二氧化硫。
方案一:(1)亚硫酸钠在空气中易氧化为硫酸钠,亚硫酸钠与盐酸反应生成氯化钠和水和二氧化硫,流程图中样品经盐酸酸化除去了亚硫酸钠,再加入氯化钡,氯化钡与硫酸钠反应生成硫酸钡沉淀和氯化钠,再通过过滤、洗涤、干燥或烘干得到沉淀,所以②、③的操作名称分别为洗涤、干燥或烘干;
方案二:(1)该同学设计实验方案的反应原理为亚硫酸钠与硫酸反应生成二氧化硫,通过测定二氧化硫的质量,计算出亚硫酸钠的质量分数。亚硫酸钠与硫酸反应生成硫酸钠和水和二氧化硫,反应的化学方程式是:H2SO4(浓)+Na2SO3 = H2O + SO2↑+ Na2SO4 ;
(2)碱石灰能吸收水蒸气和二氧化碳,装置中干燥管防止空气中的水蒸气进入U 型管装置中,对实验造成干扰;
(3)反应前装置中存在空气,空气存在的水蒸气,对实验存在干扰,反应前一般先用氮气排尽装置内的空气,防装置内空气影响;反应后装置中存在反应产生的二氧化硫,反应后用氮气把反应 产生的残留在容器内的 SO2 气体全部导入U 型管吸收装置中,确保反应产生的气体被全部吸收;
(4)设:样品中亚硫酸钠的质量为x
H2SO4(浓)+Na2SO3 = H2O + SO2↑+ Na2SO4
126 64
x m2
![]() x=
x=![]()
样品中Na2SO3的质量分数的表达式=![]() ×100%=
×100%=![]() ×100% 。
×100% 。

【题目】已知KNO3的溶解度如下表所示
温度/℃ | 10 | 20 | 30 | 40 | 50 | 60 | 70 |
溶解度/g | 20.9 | 31.6 | 45.8 | 63.9 | 85.5 | 110 | 138 |
下列说法不正确的是
A. KNO3的溶解度随温度的升高而增大
B. 20℃时,向100g水中加入35g KNO3,充分搅拌,所得溶液质量为135g
C. 通过升高温度,能将恰好饱和的KNO3溶液转化为不饱和溶液
D. 30℃时,饱和KNO3溶液中溶质的质量分数为![]() ×100%
×100%