题目内容
【题目】铁的冶炼与利用是学习和研究化学的重要课题。
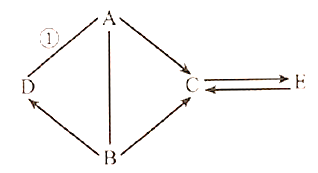
Ⅰ.铁的冶炼,竖炉炼铁的工艺流程如图1所示。
(1)“燃烧室”中CH4燃烧的作用是__
(2)写出“还原反应室”中炼铁的一个反应的化学方程式__。
(3)CH4与高温尾气中的CO2或H2O都能反应生成CO和H2,则16g CH4在催化反应室中完全反应后,理论上得到H2的质量(m)范围是__。
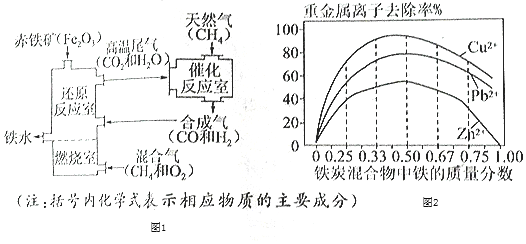
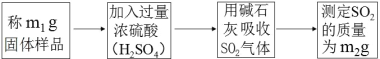
Ⅱ.铁的利用,利用铁炭混合物(铁屑和活性炭的混合物)处理含有Cu(NO3)2,Pb(NO3)2和Zn(NO3)2的铜冶炼废水。在相同条件下,测量总质量相同、铁的质量分数不同的铁炭混合物对水中重金属离子的去除率,实验结果如图2所示。
(1)铁炭混合物中铁的质量分数为100%时,水中的Cu2+、Pb2+能被除去、而Zn2+不能被除去,其原因是__。
(2)铁炭混合物中铁的质量分数为0时,也能除去水中少量的重金属离子,其原因是__。
(3)处理效果最好时,铁炭混合物中的铁的质量分数为__。
【答案】甲烷燃烧放出大量的热,提供冶炼铁需要的高温条件3H2+Fe2O3高温2Fe+3H2O
或3CO+Fe2O3高温2Fe+3CO24g<m<6g铁比铜、铅活泼,但比锌弱,所以铁可以除去铜离子、铅离子,但不能除去锌离子碳单质也能将某些金属离子还原50%
【解析】
I(1)甲烷燃烧放出了大量的热,能够给炼铁提供热量,同时生成了二氧化碳和水,提供了生产合成气的原料,所以“燃烧室”中CH4燃烧的作用是:燃烧产生热量、做生产合成气的原料;
(2)一氧化碳和氧化铁在高温的条件下生成铁和二氧化碳,化学方程式为:3CO+Fe2O3![]() 2Fe+3CO2;
2Fe+3CO2;
(3)甲烷和二氧化碳反应生成氢气的质量为x
CH4+CO2![]() 2CO+2H2
2CO+2H2
16 4
16g x
![]() =
=![]()
x=4g
甲烷和水反应生成氢气的质量为y
CH4+H2O![]() CO+3H2
CO+3H2
16 6
16g y
![]() =
=![]()
y=6g
所以理论上得到H2的质量(m)范围是4g<m<6g;
II(1)铁炭混合物中铁的质量分数为100%时,水中的Cu2+、Pb2+能被除去、而Zn2+不能被除去,原因是:铁的金属活动性排在锌的后面;
(2)铁炭混合物中铁的质量分数为0时,也能除去水中少量的重金属离子,原因是:活性炭对铜离子和铅离子具有吸附性;
(3)由图2中的数据可知,处理效果最好时,铁炭混合物中的铁的质量分数为:50%。

【题目】实验小组的同学将CO2通入氢氧化钠溶液时,没有观察到明显现象。为了能通过实验现象证明二氧化碳与氢氧化钠确实发生了反应,进行了以下探究。
(提出问题)如何能观察到反应的变化过程?
(查阅资料)
NaOH、Na2CO3在水中的溶解度
温度/℃ | 0 | 10 | 20 | 30 |
NaOH | 42 | 51 | 109 | 119 |
Na2CO3 | 7.1 | 12.2 | 21.8 | 39.7 |
NaOH、Na2CO3在乙醇中的溶解度
温度/℃ | NaOH | Na2CO3 |
18.5~25 | 17.3 | 不溶 |
(进行实验)注:乙醇在实验中只作为溶剂,不参与化学反应。
实验 | 实验装置 | 实验操作 | 实验现象 |
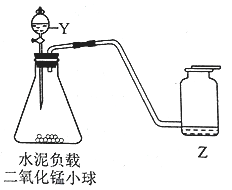
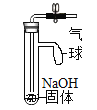
1 |
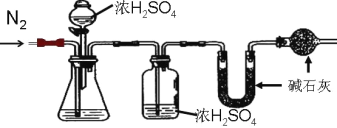
| 打开止水夹,通入 CO2,气球明显鼓起后关闭止水夹 | 一段时间后,气球明显变瘪 |
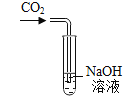
2/p> |
| 室温下,向10mL澄清饱和的NaOH溶液中通入适量CO2 | 试管内壁出现白色固体 |
3 |
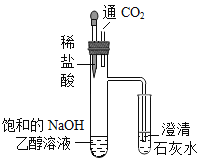
| ① 室温下,向10mL饱和的NaOH乙醇溶液中缓慢通入适量CO2 | 甲中出现白色沉淀,乙中无明显现象 |
② 滴入稀盐酸 | 甲中有气泡生成,乙中澄清石灰水变浑浊 |
(解释与结论)
(1)二氧化碳与氢氧化钠反应的化学方程式为_______。
(2)实验1中,气球明显变瘪的原因是_______。
(3)实验2中,试管内壁上出现白色固体的原因是_______。
(4)实验3甲中出现白色沉淀的原因是_______。
(5)实验3中操作②的目的是_______。
(反思与评价)
(6)实验1是从________(填“反应物消耗”或“新物质生成”)角度证明化学反应发生。