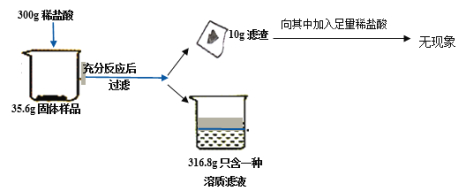
题目内容
【题目】初二中化学兴趣小组利用如下图装置进行多角度探究常见的气体的制取与性质。
探究一 气体的制取探究
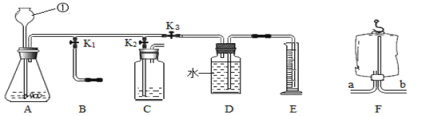
(1)写出仪器名称:①____
(2)用装置A制取二氧化碳反应的化学方程式为:___;若用该装置制取氧气,其化学方程式为:____。
(3)生活中有很多物品可以代替实验仪器。关闭K2和K3,打开K1,若用装置F所示的医用塑料袋排空气法收集CO2,则装置____(“a”或“b”)端与B装置相连。
探究二气体的性质探究
打开K2,关闭K1、K3,用于检验二氧化碳的性质
(4)若装置C中装有紫色石蕊试剂,可观察到___现象,证明了二氧化碳与水发生了反应。若装置C装有澄清石灰水,则反应化学方程式为:___。
探究三生成气体的速率研究
打开K3,关闭K1、K2,可测一段时间内生成气体的速率
(5)实验室用一定质量大理石与稀盐酸反应,所得数据如表(酸足量):
大理石质量(反应前) | 剩余固体质量(反应后) | E装置收集液体体积 | 反应时间 |
12.0g | 2.0g | 2000mL | 100s |
若生成气体的反应速率公式V=△V/△t表示,(△V表示生成气体的体积,△t表示反应时间,CO2的密度约为2g/L),则生成气体的的速率为___mL/s.
(实验思考) 若用该组合装置收集氧气,装置D上方原有的空气对收集气体的体积的测定是否有影响?并说明理由。____。
【答案】长颈漏斗 CaCO3+2HCl=CaCl2+H2O+CO2↑ ![]() a 紫色溶液变成红色 Ca(OH)2+CO2=CaCO3↓+H2O 20 没有影响,盛有水的集气瓶与大气压强相等,当有氧气生产时,集气瓶内压强增大,将水排出
a 紫色溶液变成红色 Ca(OH)2+CO2=CaCO3↓+H2O 20 没有影响,盛有水的集气瓶与大气压强相等,当有氧气生产时,集气瓶内压强增大,将水排出
【解析】
(1)据图可知仪器①是长进漏斗;
(2)实验室利用石灰石或大理石与稀盐酸反应生成二氧化碳,石灰石的主要成分是碳酸钙,碳酸钙和稀盐酸反应生成氯化钙、水和二氧化碳,方程式为:CaCO3+2HCl=CaCl2+H2O+CO2↑;此装置为固液不加热型,实验室利用过氧化氢制氧气也可用此装置,过氧化氢在二氧化锰的催化下生成水和氧气,方程式为:![]() ;
;
(3)二氧化碳的密度大于空气密度,采用向上排空气法收集,F中袋口朝下,因此二氧化碳应该从a短进;
(4)在A中反应生成了二氧化碳,二氧化碳和水反应生成碳酸,酸能使紫色石蕊变红,二氧化碳和氢氧化钙反应生成碳酸钙和水,方程式为:Ca(OH)2+CO2=CaCO3↓+H2O;
(5)装置D上方的空气对实验结果没有影响,因为盛有水的集气瓶与大气压强相等,当有氧气生产时,集气瓶内压强增大,将水排出,排出水的体积就是二氧化碳的体积。

 能力评价系列答案
能力评价系列答案 唐印文化课时测评系列答案
唐印文化课时测评系列答案 导学与测试系列答案
导学与测试系列答案