题目内容
【题目】四十九中潜能实验小组想通过某工厂煅烧一段时间之后的石灰石来判断原石灰石样品的纯度(样品中杂质不溶于水,也不和酸反应),进行了如下实验,记录数据如下:
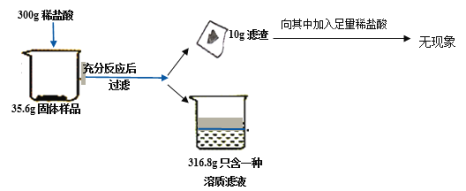
试回答下列问题:
(1)实验过程中产生明显现象的化学方程为___________.
(2)上述实验过程中产生气体的质量为___________
(3)根据气体的质量列出参加反应物质质量 (X)的比例式_________.
(4)若将最终滤液蒸发16.8g水,所得溶液中溶质的质量分数为________.
(5)若配制上述实验所用的稀盐酸200g,需要质量分数为36.5%浓盐酸的质量是_____
(6)原石灰石样品的纯度(主要成分的质量分数)为______________
【答案】CaCO3+2HCl=CaCl2+CO2↑+H2O 8.8g ![]() =
=![]() 7.4% 26.7g 56.2%
7.4% 26.7g 56.2%
【解析】
向10g滤渣中加入足量稀盐酸无现象,说明滤渣中无碳酸钙。
(1)石灰石主要成分是碳酸钙,与稀盐酸反应生成氯化钙、水、二氧化碳,CaCO3+2HCl=CaCl2+CO2↑+H2O。
(2)根据质量守恒定律,生成二氧化碳的质量是:35.6g+300g-316.8g-10g=8.8g。
(3)设参加反应的碳酸钙的质量为X,

![]() =
=![]()
(4)设反应生成氯化钙的质量为y。

![]() =
=![]() ,解得y=22.2g
,解得y=22.2g
所得溶液中溶质的质量分数为:![]() ×100%=7.4%
×100%=7.4%
(5)反应后316.8g溶液中只含有一种溶质,说明300g稀盐酸完全参加反应,设稀盐酸中溶质的质量为z,

![]() =
=![]() ,解得z=14.6g,则300g稀盐酸中所含溶质的质量为14.6g。
,解得z=14.6g,则300g稀盐酸中所含溶质的质量为14.6g。
若配制上述实验所用的稀盐酸200g,设需要质量分数为36.5%浓盐酸的质量是w,溶液稀释前后溶质的质量相等,14.6g×![]() =36.5%×w,解得w
=36.5%×w,解得w![]() 26.7g
26.7g
(6)设参加反应的碳酸钙的质量为x,

![]() =
=![]()
解得x=20g,原石灰石样品的纯度为:![]() ×100%
×100%![]() 56.2%
56.2%

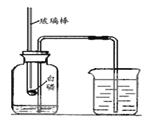
【题目】某化学兴趣小组的同学按照课本上的实验装置做“测定空气中氧气的体积分数”实验,但测出的氧气的体积分数明显小于1/5。请你参与探究:

(提出猜想)造成误差的原因可能是________________________.(写一条)
(查阅资料)红磷、白磷的一些性质如下表:
熔点/℃ | 着火点/℃ | 密度/(g/cm3) | |
红磷 | 590 | 240 | 2.34 |
白磷 | 44.1 | 40 | 1.82 |
(交流与讨论)
(1)写出红磷在空气中燃烧的化学方程式__________________
(2)他们对课本上的实验装置进行了图9所示的改进(其他仪器忽略)。
① 甲同学提出应把红磷换为白磷,理由是_______________________________。
② 通过粗铜丝来点燃玻璃管内的白磷,这利用了金属铜的__________ 性。
③ 与课本上的实验装置相比较,该装置的一个优点是________________。